Роль внеядерной фазы экзекуции.
Апоптоз является способом удаления клеток без повреждения соседних клеток, без распространения патогенной ДНК, без возбуждения иммунной реакции. Именно в течение фазы экзекуции выполняются эти эволюционные директивы. Однако пока еще точно не известно, какие события в фазе экзекуции коррелируют с эволюционно развившимися функциями апоптоза. Например, хотя блеббинг является почти универсальным свойством, не ясно, почему клетки блеббируют. Может быть, цитоплазматические блебы являются средствами механо-структурной коммуникации соседним клеткам сигналов начать процесс фагоцитоза или может быть мембранный блеббинг в погибающих клетках нужен для расходования АТФ, чтобы смешать структурные элементы в процессе упаковки клетки или как этап необходимый для грядущего формирования апоптозного тела. В любом случае стадии высвобождения, сокращения и конденсации результируют в образовании компактных клеток или клеточных фрагментов для облегчения фагоцитозной очистки.
Для клеток, у которых существуют сильные межклеточные контакты, (таких, как эпителиальные или эндотелиальные клетки) механизм цитоплазматической фазы экзекуции может быть очень важным еще и по другой причине. Сокращение апоптирующей клетки может быть неким альтруистическим способом сохранения незатронутым всего монослоя, так как погибающая клетка затрачивает свою энергию позволяя соседним клеткам закрыть потенциальную брешь, которая была бы образована на месте погибающей клетки. В эпителиальных монослоях фаза экзекуции клетки приводит к продвижению соседних клеток в сторону погибающей клетки. Стресс-фибриллы формируются в соседях, как если бы они были вытягиваемы а не сами двигались. Погибающая клетка похоже генерирует силу при помощи того же механизма который лежит в основе блеббинга (актин-миозиновое сокращение). Поэтому ингибиция блеббинга и/или конденсационной фазы должно приводить к уменьшению барьерной функции эпителия.
|
|
|
C точки зрения организма, наиболее важным аспектом апоптоза является то, что гибель (клетки) происходит без выделения потенциально патогенных или опасных макромолекул и без заражения или повреждения соседних клеток. Главная задача фазы экзекуции состоит в обеспечении гарантий, что погибающая клетка упаковывается, чтобы исключить эти потенциально опустошительные последствия.
Регуляция апоптоза.
Апоптоз может регулироваться: внешними факторами, автономными механизмами.
 Воздействие внешних факторов.
Воздействие внешних факторов.
Апоптоз может регулироваться действием многих внешних факторов, которые ведут к повреждению ДНК. При невосстановимом повреждении ДНК путем апоптоза происходит элиминация потенциально опасных для организма клеток. В данном процессе большую роль играет ген супрессии опухолей р53. К активации апоптоза также приводят вирусные инфекции, нарушение регуляции клеточного роста, повреждение клетки и потеря контакта с окружающими или основным веществом ткани. Апоптоз — это защита организма от персистенции поврежденных клеток, которые могут оказаться потенциально опасными для многоклеточного организма.
|
|
|
При стимуляции тканей каким-либо митогеном ее клетки переходят в состояние повышенной митотической активности, которая обязательно сопровождается некоторой активацией апоптоза. Судьба дочерних клеток, выживут ли они или подвергнутся апоптозу, зависит от соотношения активаторов и ингибиторов апоптоза:
ингибиторы включают факторы роста, клеточный матрикс, половые стероиды, некоторые вирусные белки; активаторы включают недостаток факторов роста, потеря связи с матриксом, глюкокортикоиды, некоторые вирусы, свободные радикалы, ионизирующая радиация.
При воздействии активаторов или отсутствии ингибиторов происходит активация эндогенных протеаз и эндонуклеаз. Это приводит к разрушению цитоскелета, фрагментации ДНК и нарушению функционирования митохондрий. Клетка сморщивается, однако мембрана ее остается интактной, но повреждение ее приводит к активации фагоцитоза. Погибшие клетки распадаются на небольшие окруженные мембраной фрагменты, которые обозначаются как апоптические тельца. Воспалительная реакция на апоптические клетки не возникает.
|
|
|
 Автономный механизм апоптоза.
Автономный механизм апоптоза.
При развитии эмбриона различают три категории автономного апоптоза: морфогенетический, гистогенетический и филогенетический.
1) Морфогенетический апоптозучаствует в разрушении различных тканевых зачатков. Примерами являются: разрушение клеток в межпальцевых промежутках;
гибель клеток приводит к разрушению избыточного эпителия при слиянии небных отростков при формировании твердого неба. Гибель клеток в дорсальной части нервной трубки во время смыкания, что необходимо для достижения единства эпителия, двух сторон нервной трубки и связанной с ними мезодермы.
2) Гистогенетический апоптоз наблюдается при дифференцировке тканей и органов, что наблюдается, например, при гормональнозависимой дифференцировке половых органов из тканевых зачатков. Так, у мужчин клетками Сертоли в яичках плода синтезируется гормон, который вызывает регрессию протоков Мюллера (из которых у женщин формируются маточные трубы, матка и верхняя часть влагалища) путем апоптоза.
|
|
|
3) Филогенетический апоптоз участвует в удалении рудиментарных структур у эмбриона, например, пронефроса.
При различных состояниях может наблюдаться как ускорение, так и замедление апоптоза. Несмотря на то, что апоптоз может быть активирован различными факторами, характерными для определенных типов клеток, однако конечный путь апоптоза регулируется точно установленными генами и является общим, независимо от причины активации апоптоза.
Каспазы.
Каспазы - это цистеиновые протеазы, которые расщепляют белок в определенных сайтах, содержащих аспарагин. На основе структурной гомологии каспазы подразделяются на подсемейства:
а) каспазы-1 (каспазы 1, 4, 5); б) каспазы-2 (каспаза-2);
в) каспазы-3 (каспазы 3, 6–10).
Активация каспаз, вероятно, является первой необратимой стадией апоптоза.
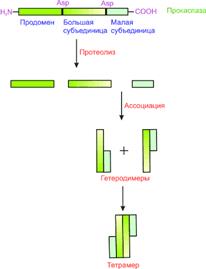 Прокаспазы обладают незначительной протеолитической активностью, составляющей 1–2% активности зрелой каспазы. Будучи в мономерной форме, прокаспазы, концентрация которых в клетке ничтожна, находятся в латентном состоянии. Предполагается, что пространственное сближение молекул прокaспаз при их агрегации ведет к образованию активных каспаз. В результате от прокаспазы (молекулярная масса 30–50 кДа) отделяется регуляторный N-концевой домен (продомен), а оставшаяся часть молекулы разделяется на большую (~20 кДа) и малую (~10 кДа) субъединицы. Затем происходит ассоциация большой и малой субъединиц. Два гетеродимера образуют тетрамер с двумя каталитическими участками, действующими независимо друг от друга. Таким образом, например, прокаспаза-8 активируется и высвобождается в цитоплазму в виде каспазы-8.
Прокаспазы обладают незначительной протеолитической активностью, составляющей 1–2% активности зрелой каспазы. Будучи в мономерной форме, прокаспазы, концентрация которых в клетке ничтожна, находятся в латентном состоянии. Предполагается, что пространственное сближение молекул прокaспаз при их агрегации ведет к образованию активных каспаз. В результате от прокаспазы (молекулярная масса 30–50 кДа) отделяется регуляторный N-концевой домен (продомен), а оставшаяся часть молекулы разделяется на большую (~20 кДа) и малую (~10 кДа) субъединицы. Затем происходит ассоциация большой и малой субъединиц. Два гетеродимера образуют тетрамер с двумя каталитическими участками, действующими независимо друг от друга. Таким образом, например, прокаспаза-8 активируется и высвобождается в цитоплазму в виде каспазы-8.
Индукция апоптоза и активация проапоптотических белков ведет к активации каспаз (цистеиновых протеаз). Среди каспаз различают инициаторные (8, 2, 10, 9) и эффекторные каспазы (3, 7, 6), т.е. происходит каскад каспаз. Конечным итогом работы эффекторных каспаз является разрушение множества белков, которые могут участвовать в поддержании гомеостаза и в репарации компонентов клетки, белков – регуляторов клеточного цикла, структурных белков и т.д.
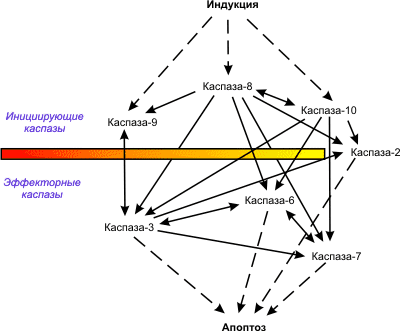 Каспаза-8 активирует каспазу второго эшелона (эффекторную каспазу): путем протеолиза из прокаспазы-3 образуется каспаза-3, после чего процесс, запущенный программой смерти, оказывается необратимым. Каспаза-3 способна в дальнейшем к самостоятельной активации (автокатализу или автопроцессингу), активирует ряд других протеаз семейства каспаз, активирует фактор фрагментации ДНК, ведет к необратимому распаду ДНК на нуклеосомальные фрагменты. Так запускается каскад протеолитических ферментов, осуществляющих апоптоз. Активация каспаз вызывает деградацию белков во многих компартментах.
Каспаза-8 активирует каспазу второго эшелона (эффекторную каспазу): путем протеолиза из прокаспазы-3 образуется каспаза-3, после чего процесс, запущенный программой смерти, оказывается необратимым. Каспаза-3 способна в дальнейшем к самостоятельной активации (автокатализу или автопроцессингу), активирует ряд других протеаз семейства каспаз, активирует фактор фрагментации ДНК, ведет к необратимому распаду ДНК на нуклеосомальные фрагменты. Так запускается каскад протеолитических ферментов, осуществляющих апоптоз. Активация каспаз вызывает деградацию белков во многих компартментах.
На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Существуют регуляторы, которые блокируют или, напротив, усиливают разрушительное действие каспаз первого эшелона. К ним относятся белки Bcl-2 (ингибиторы апоптоза: A1, Bcl-2, Bcl-W, Bcl-XL, Brag-1, Mcl-1 и NR13) и Bax (промоторы апоптоза: Bad, Bak, Bax, Bcl-XS, Bid, Bik, Bim, Hrk, Mtd). Эти белки эволюционно консервативны: гомолог Bcl-2 обнаружен даже у губок Geodia cydomium и Suberites domuncula, у которых апоптоз необходим для морфогенеза.
В результате действия каспаз происходит:
· активация прокаспаз с образованием каспаз;
· расщепление антиапоптозных белков семейства Bcl-2. Подвергается протеолизу ингибитор ДНКазы, ответственный за фрагментацию ДНК. В нормальных клетках апоптозная ДНКаза CAD (caspase-activated DNase) образует неактивный комплекс с ингибитором CAD, обозначаемым ICAD или DFF (DNA fragmentation factor). При апоптозе ингибитор ICAD с участием каспаз 3 или 7 инактивируется, и свободная CAD, вызывая межнуклеосомальные разрывы хроматина, ведет к образованию фрагментов ДНК с молекулярной массой, кратной молекулярной массе ДНК в нуклеосомных частицах – 180-200 пар нуклеотидов. Эти фрагменты при электрофоретическом разделении в агарозном геле дают характерную "лесенку ДНК". Апоптоз возможен и без фрагментации ДНК [2]. Обнаружен ядерный белок Acinus (apoptotic chromatin condensation inducer in the nucleus), из которого при комбинированном действии каспазы-3 (протеолиз при Asp 1093) и неидентифицированной протеазы (протеолиз при Ser 987) образуется фрагмент Ser 987 – Asp 1093. Этот фрагмент в присутствии дополнительных неядерных факторов вызывает апоптическую конденсацию хроматина и фрагментацию ядра (кариорексис) без фрагментации ДНК;
· гидролиз белков ламинов, армирующих ядерную мембрану. Это ведет к конденсации хроматина;
· разрушение белков, участвующих в регуляции цитоскелета;
· инактивация и нарушение регуляции белков, участвующих в репарации ДНК, сплайсинге мРНК, репликации ДНК. Мишенью каспаз является поли(ADP-рибозо)полимераза (ПАРП). Этот фермент участвует в репарации ДНК, катализируя поли(ADP-рибозилирование) белков, связанных с ДНК. Донором ADP-рибозы является NAD+. Активность ПАРП возрастает в 500 раз и более при связывании с участками разрыва ДНК. Апоптотическая гибель клетки сопровождается расщеплением ПАРП каспазами. Чрезмерная активация ПАРП при массированных разрывах ДНК, сильно снижая содержание внутриклеточного NAD+, ведет к подавлению гликолиза и митохондриального дыхания и вызывает гибель клетки по варианту некроза.
Деградация ДНК.
Одно из апоптических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза. В ходе деградации ДНК сначала происходит образование крупных фрагментов, содержащих примерно 300 тыс. пар оснований (тыс. п.о.), несколько позже - 30-50 тыс. п.о. Далее наступает следующий этап фрагментации ДНК - ее межнуклеосомная деградация, с формированием фрагментов, содержащих 180 п.о. (протяженность нити ДНК в нуклеосоме) или кратных им по величине. Именно эти фрагменты выявляются в виде "лесенки" при электрофорезе ДНК лизатов апоптотических клеток, который широко используется для идентификации апоптоза. Такая фрагментация ДНК связана с протеолитическим расщеплением специфического белка топоизомеразы II. Это белок выполняет структурную и ферментативную функции и участвует в формировании структур ДНК высшего порядка - суперспирализованных петель. Они содержат по 50 тыс. п.о. Шесть петель, объединенных в единую дисковидную розетку, образуют еще более сложную структуру и имеют в своем составе соответственно по 300 тыс. п.о. Следует напомнить, что именно на фрагменты по 50 и 300 тыс. п.о. расщепляется ДНК в начальной стадии деградации при апоптозе. Деградация топоизомеразы II каспазами является одной из причин фрагментации ДНК.
Также субстратом протеаз при апоптозе является гистон H1, который защищает ДНК от действия эндонуклеаз на межнуклеосомальном уровне. В результате этого расщепления происходит деградация ДНК на фрагменты порядка 180 п.о. и кратные им.
Осуществление различных этапов деградации ДНК связывают с проявлением активности различных эндонуклеаз. Мало сведений о характеристике эндонуклеаз, обусловливающих появление крупных фрагментов ДНК. Немногим больше сведений о процессах межнуклеосомальной деградации ДНК, в результате которой образуются фрагменты ДНК размером 180 п.о. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Апоптоз без фрагментации ДНК. Обнаружен ядерный белок Acinus (apoptotic chromatin condensation inducer in the nucleus), из которого при комбинированном действии каспазы 3 (протеолиз при Asp 1093) и неидентифицированной протеазы (протеолиз при Ser 987) образуется белок Acinus фрагмент Ser 987 - Asp 1093. Этот фрагмент в присутствии дополнительных неядерных факторов вызывает апоптотическую конденсацию хроматина и фрагментацию ядра (кариорексис) без фрагментации ДНК.
Дата добавления: 2018-09-22; просмотров: 341; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
