Химические реакции при сгорании жидкого топлива
Элементарный состав 1 кг топлива определяется из уравнения:
С + Н + ОТ = 1 кг
При полном сгорании топлива предполагается, что в результате реакции углерода и водорода с кислородом воздуха образуется соответственно углекислый газ и водяной пар. Это окисление можно записать формулами:
С + О2 = СО2 и 2Н2 + О2 = 2Н2О
При расчете исходных и конечных продуктов реакции в массовых единицах получим:
для углерода С массой С кг:
Скг[C] + 8/3Cкг[O2] = 11/3Cкг[CO2];
для водорода Н2 массой Нкг:
Нкг[H2] + 8Hкг[O2] = 9Hкг[H2O];
или в [кмоль]:
Скг[C] + С/12 кмоль[O2] = С/12 кмоль[CO2];
Нкг[H2] + H/4 кмоль[O2] = H/2 кмоль[H2O].
При сгорании углерода объем кислорода, участвующего в реакции, равен объему продуктов сгорания. При сгорании водорода объем кислорода вдвое меньше объема получающегося водяного пара.
Наименьшее количество кислорода, которое требуется подвести извне к топливу для полного его окисления, называется теоретически необходимым количеством кислорода. Известно, что для сгорания 1кг топлива необходимо
Оо = С/12 + Н/4 – От/32, [к моль]
количество воздуха
Lо = 1/0,21(C/12 + H/4 - O/32), [кмоль]
Количество воздуха для сгорания газообразного топлива с составом типа CnHmOr равно
Lо = 1/0,21  (n + m/4 - r/2)CnHmOr (моль или м3)
(n + m/4 - r/2)CnHmOr (моль или м3)
CnHmOr - объемные доли отдельных компонентов в газообразном топливе.
Коэффициент избытка воздуха
В ДВС в зависимости от способа смесеобразования, воспламенения и сгорания топлива, режима работы количество потребляемого воздуха может быть больше теоретически необходимого для полного сгорания, равно ему или меньше.
Отношение действительного количества воздуха, поступившего в цилиндр, к количеству воздуха теоретически необходимого для сгорания 1кг топлива, называется коэффициентом избытка воздуха и обозначается через  :
:
 (кг)
(кг)  =L/Lo (кмоль)
=L/Lo (кмоль)
L=Lо 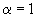 - стехиометрическая смесь;
- стехиометрическая смесь;
L>Lо  >1 - обедненная смесь;
>1 - обедненная смесь;
L<Lо  <1 - обогащенная смесь.
<1 - обогащенная смесь.
В бензиновых двигателях с воспламенением однородной смеси от искры и смешанным регулированием при полностью открытой заслонке наибольшая экономичность и достаточно устойчивое протекание процесса горения достигается при  =1,1...1,3. Максимальная мощность этих двигателей обеспечивается при некотором обогащении рабочей смеси до
=1,1...1,3. Максимальная мощность этих двигателей обеспечивается при некотором обогащении рабочей смеси до  =0,85...0,9. Устойчивая работа двигателя на холостом ходу и малых нагрузках требует большего обогащения смеси.
=0,85...0,9. Устойчивая работа двигателя на холостом ходу и малых нагрузках требует большего обогащения смеси.
При  < 1 из-за недостатка кислорода топливо не сгорает полностью, вследствие чего происходит неполное выделение теплоты при сгорании и в отработанных газах появляются продукты неполного сгорания (окисления) (CO, H, CH4 и др.).
< 1 из-за недостатка кислорода топливо не сгорает полностью, вследствие чего происходит неполное выделение теплоты при сгорании и в отработанных газах появляются продукты неполного сгорания (окисления) (CO, H, CH4 и др.).
В дизелях с применением качественного регулирования, коэффициент  в зависимости от нагрузки меняется в широких пределах (от 5 и более при малой нагрузке и до 1,4-1,25 при полной).
в зависимости от нагрузки меняется в широких пределах (от 5 и более при малой нагрузке и до 1,4-1,25 при полной).
Рис.4.2. Пределы изменения коэффициента  в зависимости от нагрузки
в зависимости от нагрузки
1 - карбюраторный ДВС; 2 - дизельный ДВС.
4.4. Горючая смесь и состав продуктов сгорания при 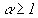 (полное сгорание)
(полное сгорание)
В карбюраторных двигателях воздух и топливо в виде горючей смеси поступают в цилиндр в процессе впуска. При полном сгорании 1кг топлива общее количество рабочей смеси, состоящей из паров топлива и воздуха
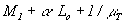 (кмоль),
(кмоль),
где 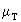 - молекулярная масса топлива.
- молекулярная масса топлива.
В дизелях топливовоздушная смесь образуется в процессе впрыска и в течение процесса горения. Вследствие этого, а также из-за малого объема, занимаемого жидким топливом, не учитывая молекулярную массу получим
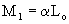 (кмоль)
(кмоль)
Для газообразного топлива (в кмоль и м3)

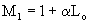
Для любого вида топлива масса смеси (в кг)
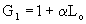
При полном сгорании 1кг жидкого топлива ( 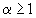 ) продукты сгорания состоят из образовавшихся в процессе реакции углекислого газа, водяного пара, избыточного 2кислорода и азота:
) продукты сгорания состоят из образовавшихся в процессе реакции углекислого газа, водяного пара, избыточного 2кислорода и азота:
M = Mсо + M 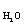 + Mо + MN
+ Mо + MN
Количества отдельных составляющих продуктов сгорания (в кмоль) определяется по формулам:
Mсо=С/12 М 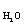 =Н/2
=Н/2
Мо=0,21(  -1)Lо МN=0,79
-1)Lо МN=0,79 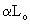
Тогда суммарное количество продуктов сгорания равно:
M2 = С/12 + Н/2 + 0,21(  -1)Lо + 0,79
-1)Lо + 0,79  Lо = С/12 + Н/2 + (
Lо = С/12 + Н/2 + (  -0,21)Lо
-0,21)Lо
Если для стехиометрической смеси (  =1)
=1)
(M2) 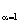 =C/12 + Н/2 + 0,79
=C/12 + Н/2 + 0,79  Lо,
Lо,
то можно записать
(M2) 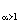 = (M2)
= (M2) 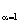 + (
+ (  -1)Lо,
-1)Lо,
где (  -1)Lо - избыточный воздух
-1)Lо - избыточный воздух
или
(M2) 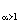 = 0,21(
= 0,21(  -1)Lо + 0,79(
-1)Lо + 0,79(  -1)Lо,
-1)Lо,
где 0,21(  -1)Lо - избыток О2;
-1)Lо - избыток О2;
0,79(  -1)Lо - избыток N2.
-1)Lо - избыток N2.
Таким образом, число киломолей продуктов сгорания складывается из продуктов сгорания при  =1 и избыточного воздуха, не участвующего в сгорании топлива.
=1 и избыточного воздуха, не участвующего в сгорании топлива.
На практике при сгорании топливовоздушной смеси даже при  >1 полного сгорания топлива не происходит. Этому способствует неоднородность топливной смеси по зонам в камере сгорания, что объясняется неравномерным распределением топлива по объему и более медленным его сгоранием в пристеночных слоях (особенно в дизелях, поэтому делают большой избыток воздуха). Совершенство сгорания оценивается анализом отработавших газов.
>1 полного сгорания топлива не происходит. Этому способствует неоднородность топливной смеси по зонам в камере сгорания, что объясняется неравномерным распределением топлива по объему и более медленным его сгоранием в пристеночных слоях (особенно в дизелях, поэтому делают большой избыток воздуха). Совершенство сгорания оценивается анализом отработавших газов.
4.5. Горючая смесь и состав продуктов сгорания при  <1 2
<1 2
(неполное сгорание)
На некоторых режимах работы ДВС с искровым зажиганием необходимо обогащать горючую смесь. В этих условиях из-за недостатка кислорода образуется СО, а часть водорода не реагирует с кислородом. Анализ отработанных газов показывает, что при  < 1 отношение числа молей водорода и окиси углерода примерно постоянно для данного топлива независимо от величины коэффициента избытка воздуха. Обозначим это отношение
< 1 отношение числа молей водорода и окиси углерода примерно постоянно для данного топлива независимо от величины коэффициента избытка воздуха. Обозначим это отношение
K = Mн/Mсо.
Согласно опытам для бензинов, у которых Н/С=0,17...0,19, отношение К=0,45...0,5, а при Н/С=0,13 К=0,3.
Продукты сгорания при  <1 состоят из следующих газов:
<1 состоят из следующих газов:
М2 = Мсо + Мсо + М 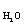 + Мн + МN.
+ Мн + МN.
Из реакции сгорания С следует, что для образования СО и СО2 требуются одинаковые количества углерода. Если сгорает 1кг топлива, то из содержащегося в нем углерода С/12 получается
Мсо + Мсо = С/12.
Аналогично для водяного пара и водорода
М 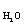 + Мн = Н/2.
+ Мн = Н/2.
Содержание азота МN = 0,79  Lо.
Lо.
Суммарное количество киломолей компонентов продуктов сгорания:
М2 = С/12 + Н/2 + 0,79  Lо.
Lо.
Составим баланс расходуемого кислорода:
М2 + Мсо/2 + Мно/2 = 0,21  Lо + От/32.
Lо + От/32.
Совместное решение двух предыдущих уравнений позволяет определить число киломолей каждого газа в продуктах сгорания:
Мсо=0,42(1-  /(1-К)Lо Мсо=С/12-0,42(1-
/(1-К)Lо Мсо=С/12-0,42(1- 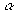 )/(1+К)Lо
)/(1+К)Lо
Мн=0,42К(1- 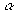 )/(1+К)Lо Мно=Н/2-0,42К(1-
)/(1+К)Lо Мно=Н/2-0,42К(1- 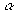 )/(1+К)Lо
)/(1+К)Lо
МN=0,79 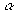 Lо.
Lо.
По мере обогащения смеси увеличивается количество СО и уменьшается СО2. При определенном значении коэффициент избытка воздуха Мсо=0, а дальнейшее обогащение приводит к появлению в продуктах сгорания несгоревшего углерода. При этом могут образовываться также оксиды азота, серы, соединения свинца.
Теплота сгорания
Качество топлива определяется теплотой сгорания, т.е. количеством теплоты, выделившемся при полном сгорании массовой (для жидкого) и объемной (для газообразного) единицы топлива.
Теплоту сгорания определяют в специальной калориметрической установке (ГОСТ 21261-75). При определении количества выделившейся теплоты продукты сгорания (т.е. углекислый газ и водяной пар), образующиеся в процессе реакции, охлаждают до первоначальной температуры. В этом случае водяной пар конденсируется с выделением теплоты. Таким образом определяют высшую теплоту сгорания Но - все количество теплоты, выделившееся в результате реакции.
В ДВС газы удаляются при температуре гораздо выше температуры конденсации водяного пара. Поэтому расчеты ведут по низшей теплоте сгорания Нн, которая меньше высшей Но на величину скрытой теплоты парообразования воды.
Если известна Но, то Нн определяется из уравнения:
Нн = Но - rв(9H + W) = Но - 2,512 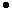 106(9H + W),
106(9H + W),
где rв - значение скрытой теплоты парообразования 1кг воды, rв=2,512 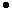 106;
106;
9H - количество водяного пара, образующегося при сгорании Н кг водорода, находящегося в 1 кг топлива;
W - количество воды, содержащейся в 1 кг топлива для газообразного топлива.
Нн = 2,512 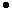 106[18/22,4
106[18/22,4 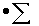 (m/2
(m/2 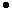 CnHmOr + W'')]
CnHmOr + W'')]
где 18/22,4 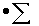 m/2
m/2 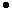 CnHmOr - количество водяного пара, образовавшегося при сгорании топлива;
CnHmOr - количество водяного пара, образовавшегося при сгорании топлива;
W' - количество влаги в газе.
Топливо образует с воздухом топливовоздушную смесь. Количество теплоты, выделяющееся при сгорании 1 киломоля такой смеси при  >1, характеризует удельную теплоту сгорания и обозначается
>1, характеризует удельную теплоту сгорания и обозначается
Нсм = Нн/М1 = Нн/( 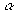 Lо + 1/
Lо + 1/ 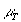 ).
).
где 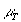 - молекулярная масса топлива;
- молекулярная масса топлива; 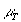 =110...120 кг/моль - для автобензина;
=110...120 кг/моль - для автобензина; 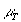 =180...200 кг/моль - для дизтоплива.
=180...200 кг/моль - для дизтоплива.
В случае недостатка воздуха ( 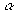 <1) имеет место неполнота выделения теплоты на величину
<1) имеет место неполнота выделения теплоты на величину 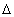 Нн, которая определяется по эмпирической зависимости
Нн, которая определяется по эмпирической зависимости
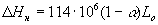 ; [Дж/кг]
; [Дж/кг]
Теплота сгорания такой смеси в этом случае, т.е. при 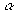 <1
<1
Нсм = (Нн - 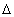 Нн)/(
Нн)/( 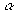 Lо + 1/
Lо + 1/ 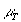 )
)
или
Нсм = (Нн - 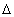 Нн)/(1 +
Нн)/(1 +  )
)
Потери теплоты (кДж) вследствие неполного сгорания 1кг топлива определяется по формуле:
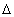 Нн = 119950(1-
Нн = 119950(1- 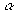 )Lо, [кДж].
)Lо, [кДж].
Дата добавления: 2018-09-20; просмотров: 1259; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
