Токсическое действие соединений железа, кобальта, никеля
На живой организм
Железо. Порог токсичности железа для человека составляет 200 мг/сутки. Летальная доза для человека: 7-35 г. Летальным исходом для ребенка может стать прием сульфата железа в дозе 3 г и выше. Недостаток содержания железа в организме является одной из самых распространенных причин возникновения анемии, обильных кровотечений, нарушения нервно-психических функций и снижения интеллекта у детей. Люди с избыточным содержанием железа страдают от физической слабости, теряют вес, чаще болеют. При этом избавиться от избытка железа намного труднее, чем устранить его дефицит. Необходимо помнить, что железо является окисляющим агентом (т.е. может явиться причиной возникновения свободных радикалов, способных разрушать ткани), поэтому не следует применять препараты железа в избыточных количествах.
Кобальт. Токсическая доза для человека 500 мг. Летальная доза для человека не определена. Летальная доза кобальта для животных составляет 25-30 мг/кг. Недостаток В12 в организме вызывает злокачественную анемию. Дефицит кобальта часто встречается у вегетарианцев, лиц с нарушениями функций органов желудочно-кишечного тракта, спортсменов, испытывающих повышенные физические нагрузки; а также при кровопотерях. Основные проявления дефицита кобальта выражаются в общей слабости, повышенной утомляемости, снижении памяти, вегетососудистых нарушениях, аритмии, замедленном развитии в детском возрасте, медленном выздоровлении после заболеваний.
|
|
|
Несмотря на то, что избыточное поступление кобальта в организм встречается довольно редко, этот процесс сопровождается различными нарушениями здоровья.Основные проявления избытка кобальта: поражение сердечной мышцы, аллергодерматиты (контактный дерматит), гиперплазия щитовидной железы, поражение слухового нерва, повышение артериального давления и уровня липидов в крови, повышение содержания эритроцитов в крови.
Никель. Металлический никель не опасен, а вот пыль и пары его соединений – токсичны. Никель способен накапливаться в роговице, поэтому отравление им может привести к значительному ухудшению зрения. Отравление никелем также негативно сказывается на пищеварительном тракте и на нервной системе. Никель – канцерогенное вещество. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил [Ni(CO)4]. Предельно допустимая концентрация никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений). Согласно ГОСТ 12.1.005-88 никель и его летучие соединения относятся к I классу опасных веществ.
Недостаточность никеля приводит к ингибированию нескольких печеночных энзимов, дезорганизует функционирование эндоплазматического ретикулума гепатоцитов, дыхательные процессы в митохондриях, изменяет содержание липидов в печени. Подобно кобальту, никель участвует в регуляции метаболизма гема в печени и почках, индуцируя активность гемоксигеназы. Повышенное содержание никеля в организме человека вызывает аллергические реакции (контактный дерматит).
|
|
|
Тема IV. d-элементы I, II группы: медь, серебро, цинк, ртуть
Биологическая роль меди, серебра, цинка, ртути
Медь. По содержанию в организме медь относится к микроэлементам, является металлом жизни и концентрируется в печени, головном мозге и в крови.
В настоящее время известно около 25 медьсодержащих белков и ферментов. Эти ферменты активируют молекулу кислорода, которая участвует в процессе окисления органических соединений. Они составляют группу так называемых оксигеназ и гидроксилаз. Имеется большая группа медьсодержащих белков, которые катализируют окислительно-восстановительные реакции с переносом протона или электронов от окисляемого вещества непосредственно на молекулярный кислород – это так называемые оксидазы. К оксидазам относится такой важнейший дыхательный фермент, как цитохромоксидаза (ЦХО), которая катализирует завершающий этап тканевого дыхания. Все ферменты тканевого дыхания связаны с внутренними мембранами митохондрий. В ходе каталитического процесса степень окисления меди цитохромоксидазы обратимо изменяется:
|
|
|
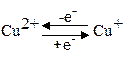
Окисленная форма цитохромоксидазы (Сu2+) принимает электроны, переходя в восстановительную (Сu+) форму, окисляющуюся молекулярным кислородом, который сам при этом восстанавливается. Затем кислород присоединяет протоны из окружающей среды и превращается в воду. Механизм действия цитохромоксидазы не полностью расшифрован. Однако доказано, что на завершающем этапе тканевого дыхания ЦХО осуществляет перенос электронов на кислород.
Одним из медьсодержащих белков, обратимо присоединяющих молекулярный кислород, является гемоцианин (НС).
Медь вместе с железом участвует в кроветворении. Известно, что при дефиците меди в организме нарушается обмен железа между плазмой крови и эритроцитами, это может привести к разрушению эритроцитов. Потребность человека в меди 2-3 мг в сутки. Она полностью обеспечивается потребляемой пищей.
Серебро − примесный микроэлемент. В организме человека содержится приблизительно 7,3 ммоль серебра. Концентрируется серебро в печени, в гипофизе, эритроцитах, в пигментной оболочке глаза.
|
|
|
Цинк является микроэлементом и относится к металлам жизни. В организме концентрируется главным образом в мышцах, печени, поджелудочной железе, тестикулах.
Цинк входит в состав более 40 металлоферментов, которые катализируют гидролиз пептидов, белков, некоторых эфиров и альдегидов. По-видимому, эта роль в определенной степени обусловлена тем, что цинк не проявляет разных степеней окисления. Постоянная степень окисления определяет его участие в реакциях гидролиза, идущих без переноса электронов.
Одним из ранее открытых и наиболее изученных является цинксодержащий фермент – карбоангидраза. Этот фермент крови, содержащийся в эритроцитах, встречается в трех формах, которые отличаются активностью. Фермент состоит приблизительно из 260 аминокислотных остатков и представляет собой бионеорганический комплекс.
Цинк, расположенный в полости комплекса является важнейшим и незаменимым компонентом активного центра фермента. При удалении Zn фермент теряет каталитическую активность. Содержание цинка в ферменте порядка 0,33%. Хотя доля металла невелика, его роль трудно переоценить. Именно благодаря этому небольшому количеству цинка образующийся в тканях оксид СО2 превращается в кислоту Н2СО3. Затем в легких идет процесс дегидратации Н2СО3. Таким образом, эта обратимая реакция влияет на процесс дыхания, на его скорость, на газообмен в организме.
Существуют ферменты, которые участвуют в гидролизе дипептидов, они называются дипептидазами, в их состав обязательно входит цинк. Цинк входит в состав гормона инсулина, который влияет на содержание сахара в крови. Другими словами, цинк участвует в углеводном обмене.
Ртуть обнаруживается во всех органах и тканях организма человека. Биологическая роль ртути не ясна.
2. Лечебное действие неорганических соединений меди, серебра и ртути
Медь. Высокое сродство металлов I группы к сере определяют большую энергию связи Ме–S, а это, в свою очередь, обусловило определенный характер их поведения в биологических системах. Катионы этих металлов легко взаимодействуют с веществами, в состав которых входят группы, содержащие cеру. Например, ионы Cu2+ реагируют с дитиоловыми ферментами микроорганизмов по схеме:
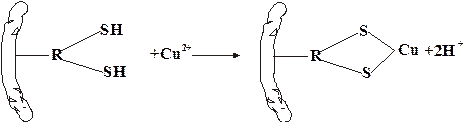
Включение ионов металлов в состав белка инактивирует ферменты, разрушает белки. Такой же механизм лежит и в основе действия лекарственных препаратов, содержащих медь и серебро, применяемых в дерматологии.
Серебро. Как и большинство тяжелых металлов, этот элемент не играет важной роли. Но как все тяжелые металлы, попадая в организм, оказывает токсическое действие, которое обусловлено тем, что, соединяясь с белками, содержащими серу, серебро инактивирует ферменты, разрушает и свертывает белки, образуя нерастворимые альбуминаты. Эта же способность серебра образовывать нерастворимые альбуминаты с белками определяет бактерицидные свойства серебра и его соединений. Уже при содержании серебра порядка 10-8 ммоль/л вода обладает бактерицидным действием. В настоящее время доказано, что бактерицидное действие ионов серебра выше таких известных дезинфицирующих средств, как карболовая кислота, хлор, хлорная известь.
Как правило, все используемые в медицине соединения серебра -препараты наружного действия. Их использование основано на вяжущих, прижигающих и бактерицидных свойствах этих соединений.
Некоторые соединения цинка и ртути в небольших концентрациях нашли применение в медицинской практике. Использование их основано на вяжущем, прижигающем и антисептическом действии. Так, цинка сульфат применяют для изготовления глазных капель (0,25%), цинка хлорид используют в стоматологической практике для прижигания папилом, для лечения воспаленных слизистых тканей. В стоматологической практике используют также цинка оксид и цинка сульфат.
3. Применение неорганических соединений меди, серебра, цинка и ртути в медицине и фармации
Cupri sulfas (меди II сульфат) CuSO4∙5H2O – антисептическое и вяжущее средство в виде 0,25% раствора при коньюнктивитах, для промывания мочевого пузыря, при уретритах и вагинитах.
Аrgenti nitras (серебра нитрат) AgNO3 – вяжущее, прижигающее и противовоспалительное средство. Назначают в виде водных растворов, мазей, а также в виде ляписных карандашей.
Stillius Lapidis (карандаш ляписный ) – для прижиганий.
Protargoli (протаргол) – вяжущее, антисептическое противовоспалительное средство для смазывания слизистых оболочек верхних дыхательных путей, для промывания мочеиспускательного канала и мочевого пузыря, в глазных каплях при коньюнктивите, блефарите.
Collargolum (колларгол) – коллоидный раствор серебра применяют в виде 0,2-1% раствора для промывания гнойных ран.
Zinci sulfas (цинка сульфат) ZnSO4∙7H2O – антисептическое и вяжущее средство при коньюнктивитах и хроническом катаральном ларингите, в редких случаях назначают внутрь как рвотное.
Zinci oxуdum (цинка оксид) ZnO – применяют наружно в виде присыпок, мазей, паст, как вяжущее, подсушивающее и дезинфицирующее средство при кожных заболеваниях.
Hydrargyri dichloridum (ртути II хлорид) HgCl2 − обладает антисептическим действием.
Hydrargyri amidochloridum (ртути амидхлорид) HgNH2Cl – обладает антисептическим действием.
В настоящее время лекарственные препараты ртути в виду токсичности не применяются.
5. Токсическое действие соединений меди, серебра и ртути
на живой организм
Медь. В больших концентрациях растворимые соли меди токсичны. Так например, сульфат меди массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты − альбуминаты, что приводит к коагуляции белков. Ионы меди образуют прочную связь с аминным азотом и с группой –SН белков, что приводит к инактивации тиоферментов.
Серебро, попадая в организм оказывает токсическое действие, обусловленное тем, что соединяясь с белками, содержащими серу, инактивирует, разрушает и коагулирует белки, образуя нерастворимые альбуминаты.
При попадании в организм больших доз растворимых солей серебра может наступить острое отравление, которое сопровождается отмиранием слизистой оболочки желудочно-кишечного тракта. Растворимые соединения цинка и ртути оказывают раздражающее действие на кожу, а при попадании внутрь организма вызывают отравление.
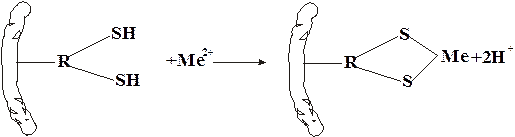
Ртуть является самым токсичным элементом Периодической системы. Отравления могут вызывать даже пары металлической ртути. Признаки отравления проявляются уже при содержании ртути в помещении в количестве 0,0002-0,0003 мг/л. Соединения ртути способны вступать во взаимодействие с сульфгидрильными группами белков, ферментов и некоторых аминокислот. При этом образуются нерастворимые соединения. Происходит подавление активности ферментов и свертывание белков.
Ионы ртути блокируют одновременно две SН–группы:
Дата добавления: 2018-09-20; просмотров: 1001; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
