Сумма коэффициентов: 1)3, 2)4, 3)5, 4)6.
Правильный ответ 3141, а не 5363. Надо знать, что в ответах цифры могут повторяться.
Затруднение вызывают и задания с множественным выбором, например:
Задание:
Реактивами на углекислый газ и этилен являются растворы:
Перманганата калия, 2)азотной кислоты, 3)гидроксида кальция, 4)хлорида натрия, 5)сульфата меди ( II ), 6)хлороводорода.
Ответ …
Не известно, сколько цифр должно быть в ответе, причем желательно написать в ответе все нужные, и не написать ничего лишнего. Вторая особенность в том, что цифры надо указывать в порядке возрастания. Если сначала написать, например, «24», а потом подумать и приписать «1», то ответ «241» будет считаться неверным, даже если «124» правильно.
При выполнении элементарных расчетных задач выпускники ошибаются при анализе условий задачи, составлении краткого условия, уравнений реакций, в расчетах. Неприятные ошибки выполняются при округлении, что приводит к нарушению численного соотношения атомов в молекуле.
Важно наличие навыков грамотного составления окислительно- восстановительных реакций, определение степени окисления, процессов передачи электронов, расстановки коэфициентов. Многие ошибки вызваны, вероятно, невнимательностью: учащиеся, правильно написав уравнение, забывают указать окислитель-восстановитель и теряют балл.
Существенные затруднения вызывают задания, проверяющие знания о взаимосвязи неорганических и органических веществ (цепочки превращений) и включаютуравнения реакций с указанием условий их протекания. В некоторые задания включают превращения соединений хрома и железа, изучение которых не предусмотрено школьной программой.
|
|
|
Задание:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cr2S3 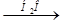 Х 1 > K2CrO4 X1
Х 1 > K2CrO4 X1 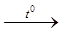 X2 > KCrO2
X2 > KCrO2
(средний балл 0,3 из 5);
K2Cr2O7 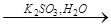 XI> > K3[Cr(OH)6]
XI> > K3[Cr(OH)6] 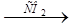 X > KCrO2
X > KCrO2 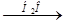 X
X
(средний балл 0,4);
KFeO 2 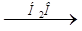 X 1
X 1 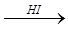 X 2
X 2 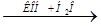 X 1 > Na 2 FeO 4
X 1 > Na 2 FeO 4 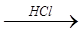 X 3
X 3
(средний балл – всего 0,1);
Fe3O4 > Fe(NO3)3 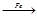 X1
X1 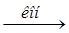 X2
X2 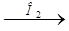 X3 > K2FeO4
X3 > K2FeO4
(средний балл – 0,3).
Трудности вызывают и те задания, в которых схема взаимосвязи веществ отсутствует, например:
Р 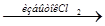 Х1
Х1 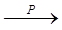 Х2
Х2 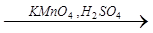 Х4
Х4 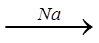 Х5
Х5
Средний балл за такое задание 0,2 , чтонеудивительно, так как все искомые вещества зашифрованы. Несмотря на то, что реакции достаточно просты и известны, ошибка на любой стадии, особенно на первой, не оставляет учащимся шансов на выполнение задания в целом.
При составлении цепочки превращений органических веществ часто верно указывая основной продукт реакции, ученик не указывает побочные вещества, не расставляет коэффициенты. Не учитываются условия протекания реакций при определении их продуктов. Так, при гидролизе эфиров в щелочной среде в качестве продуктов указываются свободные кислоты, также кислоты указываются при окислении альдегида в реакции «серебряного зеркала», хотя эта реакция протекает в избытке раствора аммиака и ее продуктами являются аммонийные соли.
|
|
|
При выполнении комбинированных заданий второй части самыми досадными являются ошибки в номенклатуре: сдающий не понимает разницы между нитратом-нитритом-нитридом, карбонатом-карбидом, фосфатом-фосфидом, хлоратом-хлоритом-хлоридом и т.д.
Много ошибок в уравнениях реакций меди с азотной кислотой, хлора со щелочью, разложения нитратов, хлоратов.
Просчеты вызваны неумением учитывать все вещества в данной системе, в данном растворе. Так, определив, в одной из задач, что азотная кислота осталась в избытке, школьники «забывают» про это, когда в раствор добавляют гидроксид натрия. Или, находя массу раствора, не учитывают, что из него выпал осадок.
Встречаются ошибки и в расчетах по уравнениям реакций, в анализе избытка-недостатка реагента.
Вызывают значительные затруднения определение формулы вещества. Эти трудности, во-первых, связаны с тем, что некоторые предлагаемые задачи на нахождение формул веществ включали незнакомый для учащихся элемент решения. В частности, требовалось установить истинную формулу методом подбора, не располагая данными о молярной массе вещества.
|
|
|
Например.При полном сгорании газообразного органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1,8 г воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения, рассчитайте его объем и массу.
В результате экзаменующиеся находят лишь простейшую формулу, а определить истинную немогут.
В задачах на продукты сгорания теряется водород, находящийся в составе галогеноводородов.
Иногда – неправильный переход от количества вещества продукта сгорания к количеству вещества элемента: n(H2O) 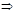 n(H).
n(H).
Часто теряется водород при чрезмерном округлении в расчетах.
Используя относительную плотность по азоту, водороду, кислороду, иногда ученик «забывает», что молекулы этих газов двухатомны.
Систематизируя опыт подготовки и учитывая анализ результатов для преодоления основных затруднений в выполнении заданий итоговой аттестации по химии в форме ЕГЭ и ОГЭ мы определили основные подходы в преодолении затруднений выпускников.
Дата добавления: 2018-09-20; просмотров: 478; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
