Вопрос № 15.Понятие энтропии.
Ds=dq/T
Энтропия является функцией состояния, поэтому ее величина определяется параметрами состояния s=f (p,V,T).
В технической термодинамике используют лишь изменение энтропии в процессах, а не ее абсолютные значения.
Энтропия системы равна сумме энтропий отдельных подсистем или тел, входящих в систему.
Вопрос №43. Передача теплоты через цилиндрическую стенку при граничных условий третьего рода.
Рассмотрим однородную цилиндрическую стенку (трубу) с постоянным коэффициентом теплопроводности λ. Заданы постоянные температуры подвижных сред tF1 и tF2 и постоянные значения коэффициентов теплоотдачи на внутренней и наружной поверхностях трубы  1 и
1 и  2 (рис. 2.7).
2 (рис. 2.7).
Согласно теории теплопередачи, зависимость теплового потока через изолированную стенку трубы от толщины изоляции следующая: сначала тепловой поток растет за счет увеличения диаметра поверхности, достигает максимума при критической толщине изоляции, и далее снижается. Критический диаметр изоляции = 2 * коэффициент теплопроводности изоляции / коэффициент теплоотдачи от наружной поверхности изоляции воздуху.
Вопрос №28 Уравнение Ван-дер-Ваальса
Как отмечалось ранее, при низких температурах и высоких давлениях уравнение Менделеева – Клапейрона для одного моля вещества дает существенные отклонения от значений, измеряемых на опыте.
Были сделаны многочисленные попытки найти уравнение состояния для реального вещества, которое могло бы охватить, если не все состояния вещества, то хотя бы газообразное и жидкое. Из множества предложенных уравнений наибольшей известностью пользуется уравнение Ван-дер-Ваальса:
записанное для одного моля вещества. Для
Постоянные a и b определяются экспериментально и имеют различные значения для разного сорта молекул. Уравнение (5.1.2) не выводится, оно устанавливается введением в уже известное уравнение Менделеева – Клапейрона двух поправок. Чтобы обосновать их введение заметим, что в уравнении (5.1.2) объем означает объем сосуда, в котором содержится один моль газа. В случае идеального газа, состоящего из материальных точек, весь этот объем доступен для движения молекул. В реальном газе сами молекулы занимают некоторую часть объема сосуда, и эта часть недоступна для всех других молекул. Эту часть объема следует вычесть из объема . Тогда уравнение (5.1.2) приобретет вид
Из последнего выражения видно, что поправка b равна тому объему, который занимал бы газ при бесконечно большом давлении, т. е. молекулы реального газа не могут сблизиться друг с другом до расстояния равного нулю, даже при бесконечно большом давлении. Поэтому введение поправки b означает приблизительный учет сил отталкивания между молекулами.
Как мы знаем, между молекулами действуют не только силы отталкивания, но и силы притяжения. Любая молекула, расположенная вблизи стенки сосуда AA' испытывает результирующую силу притяжения
со стороны молекул, расположенных в сфере действия сил притяжения.
Таким образом, в результате действия сил притяжения давление на стенку со стороны газа будет меньше, по сравнению с тем давлением (5.2.4), которое испытала бы стенка, если бы сил притяжения между молекулами не было, т. е.
Откуда находим уравнение Ван-дер-Ваальса:
Поясним появление в формуле (5.2.9) добавочного давления. Пусть газ находится в цилиндре под невесомым поршнем. Внешнее давление стремится сжать газ, т. е. сблизить его молекулы. Если бы молекулы газа друг друга не притягивали, газ испытывал бы на себе одно только внешнее давление . Но взаимное притяжение молекул, как мы выяснили, также стремится приблизить молекулы друг к другу, т. е. действует в том же направлении, как и внешнее давление . Поэтому результат притяжения молекул сказывается в кажущемся увеличении внешнего давления на газ, как будто бы к величине давления на поршень прибавилось некоторое добавочное давление .
|
5. Первый закон термодинамики
Первый закон термодинамики– изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенной к системе из вне и работе внешних сил действующих на нее:∆U=Q+A.
Аналитические выражения:
Через внутреннюю энергию и работу: dq=du+pdV
Через энтальпию: dq=dh-Vdp
33. Назначение и типы компрессоров. Термодинамический анализ работы компрессора.
Компрессорами называются устройства, предназначенные для повышения давления газов и паров. По принципу действия: объёмные и лопчатые.
В объёмных компрессорах рабочее тело сжимается механическим путём за счёт сближения ограничивающих стенок; в лопчатых компрессорах рабочему телу сообщается за счёт вращения ротора значительная скорость, а затем кинетическая энергия потока преобразутся в потонциальную (таким оразом давление рабочего тела становится выше)
Объёмные компрессоры: поршневые и ротацинные
Лопчатые компрессоры: центробежные и осевые.
|
|
|
Термодинамический анализа компрессоров разных типов одинаков, так как в любом компрессоре осуществляется процесс политропного сжатия рабочего тела.
В общем случае процесс сжатия газа в компрессоре является политропным. Значения показателя политропы лежат в интервале от n = 1 (изотермическое сжатие, охлаждаемый компрессор) до n = k (адиабатное сжатие, неохлаждаемый компрессор). Работа, затрачиваемая на сжатие, в этих процессах будет различной.
30. Техническая работа потока. Адиабатное течение газов в каналах.


Это равенство показывает, что в данном случае площадь 1-2-3-4-1, заключенная между линией процесса в аппарате 1-2 и осью ординат, изображает собой только техническую работу потока.
Если давление в аппарате понижается (как, например, в турбине), то dp<0, следовательно,  , т.е. техническая работа положительна. Это означает, что она совершается потоком над внешним объектом.
, т.е. техническая работа положительна. Это означает, что она совершается потоком над внешним объектом.
Если давление в аппарате повышается (как, например, в компрессоре), то dp>0, следовательно,  , т.е. техническая работа отрицательна. Это означает, что она совершается внешним двигателем над потоком.
, т.е. техническая работа отрицательна. Это означает, что она совершается внешним двигателем над потоком.
Может быть и такой случай, когда давление в аппарате остается неизменным. Этот случай имеет место при рассмотрении процесса нагревания или охлаждения потока в теплообменнике. Естественно, что при этом техническая работа вообще не совершается (см. тему 1), что и подтверждает равенство 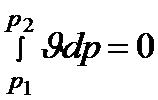 , имеющее место при dp= 0.
, имеющее место при dp= 0.
При адиабатном расширении потока техническая работа совершается им исключительно за счет снижения энтальпии и площадь фигуры 1-2-3-4-1 в этом случае, будучи равной технической работе потока, одновременно равна и разности энтальпии i1–i2, которая обозначается буквой hо и называется располагаемым теплопадением.
Адиабатное течение газов в каналах
Рассмотрим случай, когда поток движется в канале переменного сечения без совершения технической работы. Если геометрическая высота центров сечений канала не изменяется, то выражение первого закона термодинамики потока принимает вид

Полученное соотношение показывает, что изменение скорости потока в канале всегда обратно по знаку изменению давления, т.е. если давление рабочего тела в канале уменьшается, то скорость его увеличивается, и наоборот.
Каналы переменного сечения, в которых происходит расширение рабочего тела (давление уменьшается) и скорость рабочего тела увеличивается, называются соплами.
Каналы, в которых происходит обратный процесс и за счет уменьшения кинетической энергии потока (уменьшения скорости) давление его повышается, называются диффузорами. Основой для вывода общих закономерностей движения рабочего тела в соплах и диффузорах является уравнение неразрывности потока

где G – массовый расход рабочего тела;
f– площадь произвольного сечения канала.
Изменение давления и скорости потока создается противоположным воздействием геометрической формы канала на поток (очевидно, что при G=const и увеличении ω нужно уменьшить f). Это положение носит название закона геометрического обращения воздействия.
2. Термическое уравнение состояния рабочего тела
При постоянных давлениях и температуре единица количества ве-ва имеет всегда вполне определенный объем. Эту зависимость всегда можно выразить в виде функции связии давления p, удельного объема V и температуры Т.
F(p, V, T)=0
Это соотношение называется термическим уравнением состояния вещества. Три переменные p, V, T - параметры состояния. Если 2 из них известны, то третье можно определить через уравнение состояния
p=p(V, T)
V=V(p, T)
T=T(p, V)
Уравнение состояния может быть представлено в виде поверхности в пространстве с координатами p, V, T. Но в технике чаще используют кривые в плоскости 2х координат.
Для решения задач методами термодинамики необходимо знать уравнение состояния, однако оно должно быть получено опытным путем, т.к. конкретный вид уравнения зависит от индивидуальных свойств веществ.
6. Уравнение состояния идеальных газов. Законы идеальных газов.
1. Закон Бойля – Мариотта устанав-т завис-ть между удельным объемом и абсолют. давлением ИГ в процессе при пост. темп-ре. Открыт опыт. путем англ. физиком Бойлем в 1664 г., и франц. химиком Мариоттом в 1676 г.
«При постоянной температуре объем, занимаемый ИГ-ом, изм-ся обратно пропорционально его давлению»или«При пост. тем-ре произведение удельного объема на давление есть вел-на пост-ная». p·v = const.  (Т = const)
(Т = const)
2. Закон Гей-Люссакаустан-ет зав-сть между удельным объемом и абс.тем-рой при пост. давл-и. Был открыт экспер-ным путем франц. Физиком Гей-Люссаком в 1802 г.
«При постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам»
 при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры»
при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры»  , при р=const, ρ · Т = const
, при р=const, ρ · Т = const
где V0 – объем газа при температуре 0º С; V – объем газа при температуре t º С; α- температурный коэффициент объемного расширения газа , α=1/273 К-1.
3. Закон Шарляустан-ет зав-сть давления газа от его тем-ры при пост-ном удельном объеме (француз, 1737 г.).« При пост-ом объеме давление газа изменяется прямо пропорционально его абсол. температуре» р / Т = const,  , при v = const 4.Закон Авогадро: «При один-х тем-рах и давл-х в равных объемах различных ИГ содержится одинаковое количество молекул». Так как ρ=1/ v, то μ· v = const.
, при v = const 4.Закон Авогадро: «При один-х тем-рах и давл-х в равных объемах различных ИГ содержится одинаковое количество молекул». Так как ρ=1/ v, то μ· v = const.
Величина μ v предст. собой V килограмм-молекулы или киломоля (кмоль) газа. Так как в 1 м3 газа м-т соl-ся, в зав-ти от парам-в его сост-я, разные кол-ва газа, принято относить 1 м3 газа к так наз-м норм/ условиям, при к-х рабочее в-во нах-ся под дав-м р = 101 325 Па и Т = 273,15 К (760 мм рт. ст. и 0° С). Объем 1 кмоля всех ИГ равен 22,4136 м3/кмоль при нормальных условиях. Пл-сть газа при норм. усл-х опред-ся из рав-ва: ρн = μ/ 22,4 кг/м3 . Удельный объем любого газа при нормальных условиях:v н= 22,4 / μ , м3/кг
Уравнение состояния ИГ было выведено франц. Физиком Клапейроном в 1834 г. и связ-ет между собой основные параметры сост-я — давление, объем и температуру: р·V=M·R·T; p·v=R·T; p·V μ = μ R·T
где р — давление газа в Па; V— объем газа в м3; v—удельный объем газа в м3/кг; М — масса газа в кг; V μ— объем 1 кмоля газа в м3/кмоль; R — газовая постоянная для 1 кг газа в Дж/(кг • К); μ R — универсальная газовая постоянная 1 кмоля газа в Дж/(кмоль•К).
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое — к М кг; второе—к 1 кг, третье— 1 кмолю газа.
Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения R = 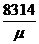 , Дж/(кг • К)
, Дж/(кг • К)
34. Многоступенчатое сжатие в компрессоре.
Для получения газов высокого давления применяют многоступенчатые компрессоры. В них сжатие газа осуществляется поэтапно в нескольких последовательно соединенных цилиндрах с промежуточным охлаждением газа после сжатия в каждом цилиндре.
Принцип работы многоступенчатого компрессора состоит в следующем. Через клапан первой ступени происходит всасывание газа. После сжатия газ через охладитель направляется во вторую ступень компрессора. Причем всасывание газа во второй ступени происходит при давлении сжатия в первой ступени.
Всасывание газа в третьей ступени выполняется через промежуточный охладитель при давлении сжатия во второй ступени. Через нагнетательный клапан третьей ступени осуществляется нагнетание газа в резервуар
 Отношение давлений для каждой ступени обычно принимается одинаковым и равным некоторой величине х.
Отношение давлений для каждой ступени обычно принимается одинаковым и равным некоторой величине х.
 Перемножим отношения давлений в каждой ступени.
Перемножим отношения давлений в каждой ступени.
Так как р2=р3 и р4=р3, то .
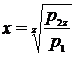 При z – ступенях компрессора для величины х получим следующую
При z – ступенях компрессора для величины х получим следующую
формулу
В случае равенства начальных температур, значений x и показателей политропы конечные температуры также будут равны, т.е. Т2=Т4=Т6.
Ступенчатое сжатие с промежуточным охлаждением приближает рабочий процесс компрессора к наиболее экономичному изотермическому сжатию, и чем больше число ступеней сжатия, тем больше процесс сжатия будет приближаться к изотермическому процессу. При равенстве температур газа на входе в каждую ступень и равенстве отношений давлений затраты работы на сжатие во всех ступенях будут одинаковыми
19 вопрос.
Если изолированная система находится в неравновесном состоянии, то в ней всегда происходят самопроизвольные необратимые процессы, приближающие ее к состоянию равновесия.В конечном итоге система приходит в состояние равновесия, самопроизвольные необратимые процессы в ней прекращаются, а энтропия перестает увеличиваться, т.е. достигает своего максимума. Это означает, что условия равновесия системы могут быть выражены аналитически условиями максимума ее энтропии, т.е. соотношениями
ds=0; 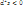
В связи с этими соображениями второй закон термодинамики может быть сформулирован так: энтропия неизолированной равновесной системы стремится к максимуму, достигая его, когда самопроизвольные процессы в ней прекращаются и система приходит в состояние равновесия.Эта формулировка показывает, что энтропия системы представляет собой параметр, изменение которого отражает не только качественные, но и количественные ограничения, накладываемые на тепловые процессы вторым законом термодинамики. В наиболее общей форме эти ограничения описываются формулой
ds≥ 
которая и является, таким образом, аналитическим выражением второго закона термодинамики.
Применительно к неизолированным системам знак равенства показывает, что все процессы обмена энергией между системой и окружающей средой обратимы, а знак неравенства свидетельствует о наличии и необратимых процессов. Применительно к изолированным системам, для которых dq = 0 и, следовательно, аналитическое выражение второго закона термодинамики принимает вид ds ≥ 0, знак равенства показывает, что в системе необратимые процессы отсутствуют, а знак неравенства свидетельствует о наличии в ней необратимых процессов.Аналитическому выражению второго закона термодинамики можно придать вид:
Tds≥dq
а поскольку по первому закону термодинамики
dq=du+dl
любой термодинамический процесс должен удовлетворять соотношению
Tds≥du+dl
которое является, таким образом, объединенным аналитическим выражением первого и второго закона термодинамики. Как ясно из предыдущего, знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
Вопрос 47
При движении без трения между отдельными слоями возникают нормальные силы (давление), а касательные силы (напряжение сдвига) – отсутствуют. “Прилипание” к стенкам, характерное для реальных жидкости или газа, значительно изменяет картину линий тока, вызывает, вследствие трения, торможение прилегающего к стенкам тонкого слоя жидкости. В этом слое скорость течения возрастает от нуля на стенке (условие прилипания) до своего полного значения во внешнем потоке. Этот слой называют пограничным слоем или слоем трения. Рассмотрим течение жидкости вдоль пластины. Толщина пограничного слоя увеличивается вдоль пластины по направлению к ее задней кромке.Внутри пограничного слоя касательное напряжение t=m(dVx/dy) весьма большое даже при малой вязкости, т.к. градиент скорости в направлении, перпендикулярном плоскости пластины, весьма велик. Вне пограничного слоя касательные напряжения очень малы. Поэтому выделяют две области: Область тонкого пограничного слоя вблизи стенки, в которой учитывают силы трения, и область вне пограничного слоя, в которой силами трения можно пренебречь, т.е. принять гипотезу идеальной жидкости.ОСНОВНОЕ УРАВНЕНИЕ ТЕПЛОПЕРЕДАЧИ При расчете теплообменных аппаратов используется кинетическое уравнение, выражающее связь между тепловым потоком Q и площадью поверхности F теплопередачи. Это уравнение называется основным уравнением теплопередачи: , Q=KFΔ  tгде K –коэффициент теплопередачи, определяющий скорость переноса теплоты;
tгде K –коэффициент теплопередачи, определяющий скорость переноса теплоты;  – средняя движущая сила или средняя разность температур между теплоносителями (средний температурный напор) по всей поверхности теплопередачи; t – время. F-площадь теплопередачи.
– средняя движущая сила или средняя разность температур между теплоносителями (средний температурный напор) по всей поверхности теплопередачи; t – время. F-площадь теплопередачи.
ВОПРОС 2. Работа изменения объема рабочего тела
Техническая термодинамика рассматривает в основном термодеформационные системы, рабочими телами которых являются газы и пары.
Чтобы определить работу деформации замкнутой неподвижной силы с однородным газообразным (или жидким) рабочим телом, следует рассмотреть бесконечно малое расширение объема занимаемого рабочим телом, в элементарном термодинамическом процессе.
Газ, заключенный в оболочку способную деформироваться без сопротивления, имеет давление и находится в равновесии с окружающей средой. При бесконечно малом расширении газа оболочка системы смещается в сторону окружающей среды на бесконечно малое расстояние, которое, может быть различным на разных участках поверхности. При этом на каждом участке с элементарной площадью поверхности бесконечно малая сила совершает над окружающей средой бесконечно малую работу. Для вычисления элементарной работы, совершаемой всей термодинамической системой, необходимо вычислить интеграл по всей поверхности.
Ввиду сравнительно малых размеров систем, рассматриваемых в технической термодинамике, давление можно принимать не зависящим от положения элементарной площадки на поверхности. Однако это условие не всегда справедливо. Например, в твердых телах напряжение зависит от положения и ориентации площадки, а в такой термодинамической системе, как атмосфера, давление воздуха меняется с высотой. В подобных случаях условие постоянства давления неприменимо.
Произведение dfdx, остающееся в подынтегральном выражении, при р — const представляет собой бесконечно малую часть приращения объема системы d2V, так что
dL =p[ df dx = р [ d2 V.
Интегрирование по поверхности дает элементарное приращение объема системы dV при деформации, поэтому d L = pdV.
Разделив полученное выражение на массу m однородного рабочего тела, заключенного в объеме V, получим выражение для элементарной удельной работы объемной деформации:
dl = dL/rn = (pdV)/m = pd (V/m) = pdv,
где v = V/m — удельный объем рабочего тела.
Абсолютное давление — существенно положительная величина, поэтому знак dl определяется знаком dv: при dv > 0 работа производится системой над окружающей средой и считается положительной, при dv < 0 работа совершается окружающей средой над системой и считается отрицательной.
P=P(v)
Эта зависимость, определяемая характером термодинамического процесса, называется уравнением процесса в переменных V, P.
Важнейшим свойством работы как формы обмена энергией является ее зависимость от характера термодинамического процесса.
I . Для термодинамических систем, обладающих более чем одной степенью свободы, вид уравнения процесса определяется не только деформационным воздействием, но и одновременно протекающим термическим воздействием, т. е. теплообменом. Это выражается зависимостью давления от двух переменных — объема и, например, температуры, а действительная линия такого процесса представляет собой пространственную кривую в координатах р, v, Т. Одно и то же конечное состояние системы может быть достигнуто в ходе различных термодинамических процессов, изображающихся различными пространственными линиями на поверхности состояний р, v, Т.
Таким образом, работа термодинамического процесса не может быть вычислена по начальному и конечному состояниям системы, она является функцией характера термодинамического процесса, а не состояния системы. В связи с этим не может существовать функция, выражающая работу только через параметры состояния, и элементарная работа не обладает математическими свойствами полного дифференциала. Это бесконечно малое (элементарное) количество энергии, переданной рабочим телом окружающей среде определенным способом.
ВОПРОС 32 ДРОССЕЛИРОВАНИЕ ГАЗОВ
Процесс дросселирования
Процесс понижения давления реального газа или пара при переходе через препятствие без совершения технической работы называется дросселированием. При некоторых условиях в результате дросселирования снижается температура газа — этот эффект используют в холодильной технике. В тепловых двигателях при течении рабочего тела (реального газа или пара) по трубам с вентилями, клапанами или другими препятствиями происходит процесс дросселирования, в результате которого снижается работоспособность рабочего тела, в связи с чем уменьшается коэффициент полезного действия двигателя.
Если процесс дросселирования протекает без обмена теплотой С окружающей средой (т. е. адиабатно), то в процессе дросселирования энтальпия не изменяется.
Так как в процессах дросселирования изменение скорости очень мало, то им можно пренебречь. Таким образом, в результате дросселирования энтальпия газа не изменяется. Этот вывод получен на основании уравнения первого закона термодинамики и поэтому ОН справедлив как для реальных газов и паров, так и для капельных жидкостей.
При переходе газа или пара через диафрагму скорость его движения должна стать больше так как площадь проходного сечения диафрагмы меньше проходного сечения канала. После диафрагмы скорость должна вновь уменьшиться так как площадь проходного сечения канала увеличивается. Если при этом выполняется условие равенства скоростей течения газа или пара в сечениях, то можно предположить, что в этих сечениях должны выровняться и давления. Однако в действительности pL оказывается большим рг. Это объясняется тем, что часть разности кинетических энергий движения потока через диафрагму и после нее преобразуется в теплоту, однако ее не хватает для повышения давления текущего вещества в сечении.
Дифференциальный дроссель-эффект
Опытами установлено, что в результате дросселирования при снижении давления изменяется температура. Это явление называется эффектом Джоуля — Томсона. Важной характеристикой процесса дросселирования является значение производной
(dT/dp)i = аi
называемой дифференциальным дроссель-эффек т о м, причем индекс указывает на то, что дросселирование протекает при i = const или df = 0; ai характеризует скорость изменения температуры газа при изменении давления в результате дросселирования. Значение аi- для любого вещества (реального газа, пара или капельной жидкости) можно определить с помощью уравнений первого и второго законов термодинамики.
Эффект Джоуля — Томсона ai = 0 наблюдается только при течении реальных газов и паров по каналам с препятствиями.
Физическая сущность эффекта Джоуля—Томсона
Пусть адиабатный процесс дросселирования осуществляется при перетекании газа из одного цилиндра в другой сквозь трубку малого диаметра, а давление газа слева и справа от трубки поддерживается постоянным с помощью двух подвижных поршней.
Левый поршень, воздействуя на каждый килограмм газа, совершает работу, равную P1v1, правый — P2v2. По первому закону термодинамики, изменение энергии газа должно быть равно сумме внешних воздействий. В рассматриваемом процессе происходит изменение внутренней и кинетической энергий вещества без теплообмена с окружающей средой (dq = 0),
если затрата внешней энергии — больше, чем приращение внутренней потенциальной энергии, то избыток внешней энергии идет на увеличение кинетической энергии и температура газа при дросселировании повышается. Этим объясняется физическая сущность отрицательного дроссель-эффекта;
если затрата внешней энергии — равна приращению внутренней потенциальной энергии, то приращение внутренней кинетической энергии = 0 и температура газа не меняется. Этим объясняется физическая сущность дросселирования, когда дроссель-зффект равен нулю;
если затрата внешней энергии — меньше, чем вызванное расширением приращение внутренней потенциальной энергии, то разность между их абсолютными значениями покрывается уменьшением внутренней кинетической энергии. При этом температура газа понижается. Действительно, при понижении давления (увеличении объема) преодолеваются силы притяжения между молекулами и газ совершает некоторую внутреннюю работу. На это затрачивается часть внутренней (кинетической) энергии — температура газа понижается. Этим объясняется физическая сущность положительного дроссель-эффекта.
Дата добавления: 2018-08-06; просмотров: 288; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

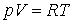

 молей это уравнение имеет вид:
молей это уравнение имеет вид:



