Для всех видов термодинамических процессов величина первого члена уравнения (24) постоянна, а второго зависит от характера сообщения тепла.
В случае подвода тепла при постоянном давлении величина удельной работы равна газовой постоянной:
 (25)
(25)
 (26)
(26)
Уравнение .(26) называется уравнением Майера и является одним из основных в технической термодинамике.
Отношение величины теплоемкости при постоянном давлении к теплоемкости при постоянном объеме равно показателю адиабаты данного газа:
 (27)
(27)
Если известен показатель адиабаты и газовая постоянная, то можно определить теплоемкости  и
и  :
:
 или
или  ,тогда
,тогда  (28)
(28)
 (29)
(29)
Для заданных пределов температур величины средних теплоемкостей  и
и  запишутся:
запишутся:

 (30)
(30)
В справочных таблицах обычно приводится средняя теплоемкость от 0°С до различных температур. При теплотехнических расчетах необходимо знать среднее значение теплоемкости в пределах температур от t1 до t2. В таких случаях средняя теплоемкость определяется по формулам 31 и 32.
От 0°С до температур t1, и t2 средняя теплоемкость определяется линейной интерполяцией. Теплоемкость в интервале температур от t1 до t2 определяется по формуле:
 (31)
(31)
Среднюю теплоемкость в пределах температур t1, и t2 можно определить
|
|
|
по графику С=¦(t). (См. рис. 1) Теплоемкость смеси газов между заданными температурами определяется в следующем порядке:
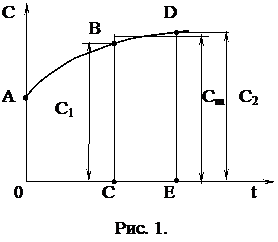 а) определяется теплоемкость между заданными температурами раздельно для составляющих газов (по формуле 31);
а) определяется теплоемкость между заданными температурами раздельно для составляющих газов (по формуле 31);
б) теплоемкость смеси определяется по формуле:
 (32)
(32)

Энтальпия.
В термодинамике важную роль играет величина суммы удельной внутренней энергии системы u и произведения давления р на величину удельного объема системы и v, называемая энтальпией i:
 (33)
(33)
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния и поэтому может быть представлена в виде суммы, т. е. функции двух любых параметров состояния:


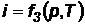 (34)
(34)
Поскольку энтальпия есть функция состояния, di является полным дифференциалом, и, следовательно, изменение энтальпии в любом процессе определяется только начальным и конечным состоянием тела и не зависит от характера процесса.
 (35)
(35)
Из уравнения первого закона термодинамики  в случае, когда единственным видом работы является работа расширения и
в случае, когда единственным видом работы является работа расширения и  то:
то:
|
|
|
 или
или  (36)
(36)
Из этого соотношения следует, что если давление системы сохраняется неизменным, т.е. осуществляется изобарный процесс (dр = 0), то:


т.е. теплота, подведенная к системе при постоянном давлении, расходуется только на изменение энтальпии данной системы.
Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах камерах сгорания газовых турбин, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии.
Для идеального газа справедливо выражение:
 (39)
(39)
Энтропия.
Энтропией называется некоторая функция состояния тела, которая определяется из соотношения:
 Дж/(кг. К); (40)
Дж/(кг. К); (40)
физический смысл этого понятия (энтропия) - мера термодинамической вероятности состояния газа. Так как абсолютная температура газа всегда положительна, то при подводе теплоты энтропия газа повышается, при отводе - понижается.
|
|
|
Из формулы  интегрируя, получаем
интегрируя, получаем  . (41)
. (41)
Выражая количество тепла через энтальпию, получаем:
 (42)
(42)
или  (43)
(43)
Уравнение состояния идеального газа в дифференциальной форме имеет вид:

Подставив это значение в уравнение (43), получим:

или 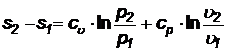 . (44)
. (44)
Основные газовые процессы.
Основными термодинамическими газовыми процессами являются:
изохорный процесс - процесс сообщения или отвода тепла от газа при постоянном объеме;
изобарный процесс - при постоянном давлении;
изотермический процесс - при постоянной температуре;
адиабатический процесс - процесс, протекающий без подвода или отвода теплоты;
политропный процесс - процесс изменения состояния газа, определяемый уравнением:
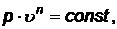 (45)
(45)
где n - показатель политропы (постоянный для данного процесса).
|
|
|
Политропный процесс является обобщающим. Все перечисленные процессы могут быть получены из него.
Изохорный процесс -  = сопst. Для этого процесса n = ± ¥. Из уравнения состояния при
= сопst. Для этого процесса n = ± ¥. Из уравнения состояния при  = соnst, находим:
= соnst, находим:
 (46)
(46)
где р1, Т1 - параметры газа в начале процесса;
р2, Т2 - параметры газа в конце процесса.
Изменение внутренней энергии 1 кг газа в процессе:
 (47)
(47)
Изменение, энтальпии:
 (48)
(48)
Так как при протекании изохорного процесса объем газа не изменится dv=0,
то  , следовательно, работа изохорного процесса равна нулю.
, следовательно, работа изохорного процесса равна нулю.
Изменение энтропии 1 кг газа выражается формулой:
 (49)
(49)
Изохорный процесс в  - диаграмме изображается прямой, параллельной оси ординат, а в ТS - диаграмме - логарифмической кривой.
- диаграмме изображается прямой, параллельной оси ординат, а в ТS - диаграмме - логарифмической кривой.
Изобарный процесс р = соnst. Для этого процесса n =0. Из уравнения состояния при р = соnst находим:
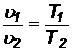 (50)
(50)
Изменение внутренней энергии 1 кг газа:
 (51)
(51)
Изменение энтальпии 1кг газа:
 (52)
(52)
Работа газа в процессе определяется интегрированием выражения  при р = соnst, тогда:
при р = соnst, тогда:
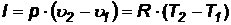 (53)
(53)
Изменение энтропии:
 (54)
(54)
В  - диаграмме изобарный процесс изображается прямой, параллельной оси абсцисс.
- диаграмме изобарный процесс изображается прямой, параллельной оси абсцисс.
Площадь под этой прямой выражает в определенном масштабе величину работы.
В ТS - диаграмме процесс изображается логарифмической кривой, а площадь под ней показывает количество тепла в масштабе.
Изотермический процесс Т = соnst. Для этого процесса n =1. Из уравнения состояния при Т = соnst следует рv = соnst:
 (55)
(55)
Так как температура газа в процессе не изменяется, то изменение внутренней энергии и энтальпии равно нулю, то есть в течение процесса внутренняя энергия и энтальпия остаются постоянными.
Следовательно, в этом процессе все количество подведенного тепла превращается в работу:
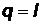 (56)
(56)
Работа газа за процесс, Дж/кг:
 (57)
(57)
Изменение энтропии за процесс, Дж/(кг·К):
 (58)
(58)
В  -диаграмме процесс изображается равнобокой гиперболой, в TS-диаграмме - прямой, параллельной оси абсцисс.
-диаграмме процесс изображается равнобокой гиперболой, в TS-диаграмме - прямой, параллельной оси абсцисс.
Адиабатный процесс dq = 0. Адиабатное изменение состояния газа выражается уравнением:
 (59)
(59)
где  - показатель адиабаты.
- показатель адиабаты.
Из уравнения адиабаты  и уравнения состояния находим:
и уравнения состояния находим:

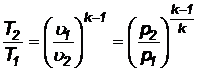 (60)
(60)
Для этого процесса первый закон термодинамики  и
и  . Tо есть работа в адиабатном процессе совершается за счет изменения внутренней энергии газа:
. Tо есть работа в адиабатном процессе совершается за счет изменения внутренней энергии газа:
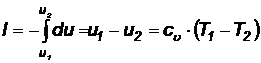 (61)
(61)
Подставляя  ,
,  ,
,  , находим работу, которую совершает 1 кг газа в процессе:
, находим работу, которую совершает 1 кг газа в процессе:
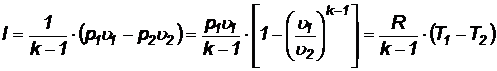 (62)
(62)
Из  , при dq= 0 находим ds =0 или s1 = s2; т.е. энтропия идеального газа в обратимом адиабатном процессе не изменяется (процесс изоэнтропийный).
, при dq= 0 находим ds =0 или s1 = s2; т.е. энтропия идеального газа в обратимом адиабатном процессе не изменяется (процесс изоэнтропийный).
В  -диаграмме процесс изображается (согласно уравнению) неравнобокой гиперболой; в ТS-диаграмме - вертикальной прямой (изоэнтропой).
-диаграмме процесс изображается (согласно уравнению) неравнобокой гиперболой; в ТS-диаграмме - вертикальной прямой (изоэнтропой).
Политропный процесс. Уравнение процесса  . Так же, как и для адиабатного, находим:
. Так же, как и для адиабатного, находим:

 (63)
(63)
Изменение внутренней энергии газа 
Количество тепла в процессе определяется по формуле:
 (64)
(64)
где  - теплоемкость политропного процесса.
- теплоемкость политропного процесса.
Величина  может быть получена из выражения:
может быть получена из выражения:
 (65)
(65)
которое было получено при выводе уравнения политропы.
Тогда
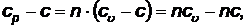
 или
или
 (66)
(66)
Так же, как и для адиабатного процесса, находим выражение для работы процесса:
 (67)
(67)
Изменение энтропии в процессе - по формулам (41), (42), (43).
Показатель попитропного процесса может быть определен по заданным теплоемкостям - формула (66) или в результате логарифмирования уравнения:
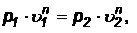
 (68)
(68)
Задаваясь- различными численными значениями n, можно получить все основные термодинамические процессы, как показано на рис.2
 P n= ±¥ T n=k n= ±¥
P n= ±¥ T n=k n= ±¥
n=k n=0
n=1
n=1 n=1
n=0 n=0
n=0
n=1
n= ±¥ n=k n= ±¥ n=k
 S
S
Рис 2
3. Контрольные вопросы
1. Объяснить, что называется идеальным газом, и показать его отличие от реальных газов.
2. Написать и объяснить физическую сущность уравнения состояния идеальных газов. Дать определение универсальной и удельной газовых постоянных.
3. Сформулировать, написать и объяснить физическую сущность экспериментальных газовых законов: Бойля-Мариотта, Гей-Люссака Авогадро Дальтона.
4. Объяснить способы задания газовых смесей, показать, как находится кажущаяся молекулярная масса и газовая постоянная смеси.
5. Объяснить, что называется истинной и средней теплоемкостью газа и от каких параметров они зависят. Показать, как связаны между собой мольная, массовая и объемная теплоемкости.
6. Написать соотношение между теплоемкостью при постоянном давлении и теплоемкостью при постоянном объеме. Объяснить, как находится средняя теплоемкость газа от 0°С до заданной температуры и средней теплоемкости от t1 до t2, пользуясь таблицами средних теплоемкостей и графиком.
7. Как находится теплоемкость смеси газов?
8. Привести формулировку и написать аналитическое, выражение первого закона термодинамики.
9. Объяснить, что такое внутренняя энергия газа?
10. Объяснить, что такое теплота?
11. Объяснить, что такое работа изменения объема рабочего тела?
12. Объяснить, что такое энтальпия и ее физическую сущность?
13. Написать уравнение и объяснить физическую сущность изохорного и изобарного процессов.
14. Объяснить физическую сущность изотермического процесса и провести анализ формулы, связывающей между собой параметры газа в этом процессе.
15. Объяснить физическую сущность адиабатного процесса и провести анализ формул, связывающих между собой параметры газа в этом процессе.
16. Объяснить физическую сущность политропного процесса и провести анализ формулы, связывающей параметры газа в этом процессе.
17. Изобразить схематически в  и ТS - диаграммах все термодинамические процессы как частные случаи политропного процесса. Привести значения показателей политроп для каждого процесса.
и ТS - диаграммах все термодинамические процессы как частные случаи политропного процесса. Привести значения показателей политроп для каждого процесса.
18. Объяснить, как находится показатель политропы по заданным параметрам газа в двух точках политропного процесса?
19. Написать и объяснить уравнения изменения энтропии для различных термодинамических процессов.
Литература:
1. Баскаков А. П., Берг Б. В., Витт О. К. И др. -Теплотехника-М.: Энергоиздат, 1982, 264с.
2. Рабинович О. М. Сборник задач по технической термодинамике.
М.: Машиностроение, 1973, 344с.
Приложение
Задание
на расчетно-графическую работу №1
газовая смесь:mo2=0,3 ; 
Параметры точек процесса для вариантов задания
| предпоследняя цифра номера зачетной книжки | последняя цифра номера зачетной книжки | точки процесса | параметры газа Р,МПа | параметры газа

| параметры газа t, 0C |
| 0 или 1 | 1 | 1 | 0,033 | - | 221 |
| 2 | 0,33 | 0,6 | - | ||
| 2 | 1 | - | 8,457 | 423 | |
| 2 | 0,52 | - | 1000 | ||
| 3 | 1 | 0,042 | 4,7 | - | |
| 2 | - | 0,4 | 714 | ||
| 4 | 1 | 0,079 | - | 220,6 | |
| 2 | 0,33 | 0,6 | - | ||
| 5 | 1 | 0,24 | 13,024 | - | |
| 2 | - | 4,498 | 770 | ||
| 6
| 1 | - | 8,839 | 250,2 | |
| 2 | 0,393 | - | 706 | ||
| 7
| 1 | 0,29 | - | 680 | |
| 2 | 0,294 | 1,318 | - | ||
| 8
| 1 | 0,14 | 2,84 | - | |
| 2 | 0,52 | - | 1023 | ||
|
9 | 1 | 0,62 | - | 655 | |
| 2 | 0,062 | 6 | - | ||
|
0 | 1 | 0,135 | - | 717 | |
| 2 | - | 1 | 1023 | ||
| 2 или 3 | 1 | 1 | 0,33 | 0,6 | - |
| 2 | - | 1,09 | 632 | ||
| 2 | 1 | 0,52 | - | 1000 | |
| 2 | - | 0,788 | 750 | ||
| 3 | 1 | - | 0,4 | 714 | |
| 2 | 0,99 | 0,33 | - | ||
| 4 | 1 | 0,33 | 0,6 | - | |
| 2 | - | 1,1 | 632 | ||
| 5 | 1 | - | 4,498 | 770 | |
| 2 | 0,093 | - | 1048,8 | ||
| 6
| 1 | 0,393 | - | 706 | |
| 2 | 0,53 | 1 | - | ||
| 7
| 1 | 0,294 | 0,294 | - | |
| 2 | - | 0,2 | 1252 | ||
| 8
| 1 | 0,52 | - | 1023 | |
| 2 | - | 0,4 | 246 | ||
|
9 | 1 | 0,062 | 6 | - | |
| 2 | - | 10 | 1273 | ||
|
0 | 1 | - | 1 | 1023 | |
| 2 | 0,52 | - | 245 | ||
| 4 или 5 | 1 | 1 | - | 1,09 | 632 |
| 2 | 0,202 | - | 550 | ||
| 2 | 1 | - | 0,788 | 750 | |
| 2 | 0,033 | 12,43 | - | ||
| 3 | 1 | 0,99 | 0,33 | - | |
| 2 | 0,6 | - | 221,9 | ||
| 4 | 1 | - | 1,1 | 632 | |
| 2 | 0,23 | - | 361 | ||
| 5 | 1 | 0,093 | - | 1048,8 | |
| 2 | 0,024 | 13 | - | ||
| 6
| 1 | 0,48 | 0,83 | - | |
| 2 | 3,98 | - | 720 | ||
| 7
| 1 | - | 0,2 | 1252 | |
| 2 | 3,057 | 0,125 | - | ||
| 8
| 1 | - | 0,4 | 246 | |
| 2 | 0,9 | - | 717 | ||
|
9 | 1 | - | 10 | 1273 | |
| 2 | 0,16 | - | 129 | ||
|
0 | 1 | 0,52 | - | 245 | |
| 2 | 0,994 | 0,4 | - | ||
| 6 или 7 | 1 | 1 | 0,29 | - | 624 |
| 2 | 2,9 | 0,124 | - | ||
| 2 | 1 | 0,033 | 12,43 | - | |
| 2 | - | 8,46 | 423 | ||
| 3 | 1 | 0,6 | - | 221,9 | |
| 2 | 0,042 | 4,7 | - | ||
| 4 | 1 | 0,23 | - | 361 | |
| 2 | 0,079 | - | 220,6 | ||
| 5 | 1 | - | 0,124 | 624 | |
| 2 | 2,9 | 0,129 | - | ||
| 6
| 1 | 0,04 | - | 608,5 | |
| 2 | - | 8,84 | 250,2 | ||
| 7
| 1 | 3,057 | 0,125 | - | |
| 2 | 0,29 | - | 680 | ||
| 8
| 1 | 0,9 | - | 717 | |
| 2 | 0,14 | 2,84 | - | ||
|
9 | 1 | 0,016 | - | 129 | |
| 2 | 0,62 | - | 655 | ||
|
0 | 1 | 0,994 | 0,4 | - | |
| 2 | 0,135 | - | 717 | ||
| 8 или 9 | 1 | 1 | 3,98 | - | 720 |
| 2 | - | 0,1 | 250 | ||
| 2 | 1 | 2,1 | - | 513 | |
| 2 | - | 0,15 | 200 | ||
| 3 | 1 | 2,097 | - | 1060,6 | |
| 2 | 0,48 | 0,83 | - | ||
| 4 | 1 | 2,9 | 0,129 | - | |
| 2 | 0,156 | - | 209 | ||
| 5 | 1 | 0,15 | 2,7 | - | |
| 2 | 2,44 | - | 730 | ||
| 6
| 1 | - | 0,14 | 580 | |
| 2 | 0,15 | 2 | - | ||
| 7
| 1 | 0,156 | - | 209 | |
| 2 | - | 1,24 | 624 | ||
| 8
| 1 | 1,265 | - | 974 | |
| 2 | - | 2,07 | 513 | ||
|
9 | 1 | - | 1,21 | 175 | |
| 2 | 0,15 | 2,7 | - | ||
|
0 | 1 | 0,024 | 15,24 | - | |
| 2 | - | 3 | 1119 |
Дата добавления: 2018-08-06; просмотров: 234; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
