Основные термодинамические параметры газа. Уравнение состояния.
Nbsp; МИНИСТЕРСТВО ОБЩЕГО ОБРАЗОВАНИЯ РФ ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Электротехнический факультет Кафедра теплотехники и гидравлики
РАСЧЕТ
ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ
В ПЕРЕМЕННЫХ ТЕПЛОЕМКОСТЯХ
Методические указания
к расчетно-графической работе №1
Дисц. ”Теплотехника”
Для спец. ММД (1704)
Киров 2003
УДК 658.26.075
Составители: к.т.н., доц. В.В.Скопин
к.т.н., доц. Д.М.Суворов
к.т.н.. доц. И.В.Шестаков
Рецензент: доцент М.В.Николайчук,
кафедра ММД
Редактор А.Н.Корсаков
ЛР № 020519 от 20.06.97г.
Подписаноано в печать 31.08.98 Усл.печ. л. 1,2
Бумага типографская. Печать матричная.
Заказ № 225 Тираж 50 Бесплатно.
Текст напечатан с оригинал-макета, предоставленного автором
______________________________________________________________
610 000, г. Киров, ул. Московская, 36.
Оформление обложки, изготовление – ПРИП
© Вятский государственный университет, 1998
Право на данное издание принадлежат Вятскому
государственному университету
Введение
Расчетно-графическая работа (РГР) рекомендуется студентам специальности 170400 ММД (машины и оборудование лесного комплекса) изучающим дисциплину «Теплотехника».
|
|
|
Цель РГР заключается в повторении и закреплении теоретического материала по разделу «Техническая термодинамика» и в приобретении навыков расчета газовых процессов тепловых двигателей.
Объем задач порядок выполнения и оформления РГР.
1.1 . Задачей РГР является:
а) Определение недостающих параметров рабочего тела в начальных и конечных точках процесса (1 и 2).
б) Определение показателя политропы процесса (1-2).
в) Определение удельных (т.е. отнесенных к одному килограмму рабочего тела): работы в процессе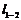 , изменения внутренней энергии Du1-2, энтальпии Di1-2 и энтропии Ds1-2 , отведенной или подведенной в процессе теплоты q1-2.
, изменения внутренней энергии Du1-2, энтальпии Di1-2 и энтропии Ds1-2 , отведенной или подведенной в процессе теплоты q1-2.
г) Графическое изображение процесса в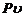 и
и 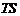 диаграммах.
диаграммах.
Порядок выполнения РГР.
Из таблицы задания в приложении каждый студент согласно номеру зачетной книжки выписывает параметры точек процесса. Газовая смесь для всех вариантов задания одинакова.
Затем определяются массовая доля и вид неизвестного газа, недостающие параметры и вид процесса. Далее вычисляются теплоемкость компонентов и смеси газов, работа, количество подведенного или отведенного в процессе тепла, изменение энтальпии и энтропии. В заключение анализируются результаты расчетов, выполняются рисунки в 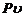 и
и 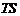 диаграммах и делаются выводы по РГР.
диаграммах и делаются выводы по РГР.
|
|
|
Порядок оформления работы.
1. Работа оформляется на стандартных листах бумаги 210 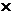 297, которые затем сшиваются.
297, которые затем сшиваются.
2. Каждый пункт расчета должен иметь наименование и минимум необходимых пояснений, ссылки на источники, по которымпринимаются значения величин (например, теплоемкость). Надписи должны быть четкими и аккуратными.
3. У всех размерных величин должна быть проставлена их размерность.
4. Графическое изображение процесса в 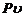 и
и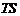 диаграммах должно выполняться на миллиметровой бумаге. На осях координат следует нанести соответствующие масштабы равномерных шкал.
диаграммах должно выполняться на миллиметровой бумаге. На осях координат следует нанести соответствующие масштабы равномерных шкал.
5. Неправильно или небрежно оформленный отчет, а также отчеты, выполненные в школьных тетрадях, к рассмотрению не принимаются.
2. Основные теоретические положения.
Основные термодинамические параметры газа. Уравнение состояния.
Параметрами газа называются величины, характеризующие рабочее тело (газ) в данном состоянии.
Основными параметрами газа являются:
|
|
|
Удельный объем – объем единицы массы газа.
В технической термодинамике за единицу объема принимается кубический метр (м3). Следовательно, удельный объем есть объем одного килограмма вещества:
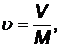 м3/кг, (1)
м3/кг, (1)
где М – масса газа, кг
V – объем газа с массой, равной М, м3.
Плотность вещества -масса единицы объема:
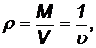 кг/м3 (2)
кг/м3 (2)
Абсолютное давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней.
В международной системе единиц (СИ) давление измеряется в паскалях (1 Па =1 Н/м2). Поскольку эта единица мала (1кгс/см2= 1ат=98066,5 Па), удобно использовать1кПа = 103 Па или 1МПа = 106 Па.
Давление измеряется при помощи манометров, барометров и вакуумметров. Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением Р измеряемой среды и атмосферным (барометрическим) давлением В:
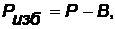 (3)
(3)
|
|
|
Приборы для измерения давления ниже атмосферного давления называют вакуумметрами, их показания дают значение разряжения (или вакуума):
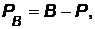 (4)
(4)
Абсолютная температура - физическая величина, служит мерой кинетической энергии молекул. В системе СИ единицей температур являетсякельвин (К); на практике широко применяется градус Цельсия (°С).Соотношение между ними имеет вид:
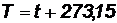 (5)
(5)
Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие "нормальные условия".
В технической термодинамике обычно используют физические нормальные условия:
Р= 760 мм рт. ст. = 101325 Па; Т =273,15 К;
Следует отметить, что параметрами состояния являются абсолютные давления и температура.
Рассмотренные выше параметры газа связаны между собой уравнением состояния (характеристическим уравнением), которое для одного килограмма газа имеет вид:
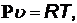 (6)
(6)
где P- абсолютное давление газа, Па;
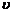 - удельный объем, м3/кг;
- удельный объем, м3/кг;
T - абсолютная температура, К;
R - удельная газовая постоянная, Дж/(кг.К).
Удельная газовая постоянная численно равна работе, совершаемой единицей массы газа при изменении его температуры на один кельвин в процессе при постоянном давлении. Газовая постоянная, отнесенная к одному киломолю газа, называется универсальной газовой постоянной и для всех газов равна:
Rm = 8314,2 Дж/(кмоль .К).
Удельная газовая постоянная определяется по формуле:
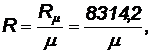 Дж/(кг .К), (7)
Дж/(кг .К), (7)
где m - молекулярная масса газа, кг/кмоль.
Уравнение состояния может быть легко установлено из экспериментальных законов: Бойля-Мариотта, Гей-Люссака и Авагадро.
Газовые смеси.
Состав газовой смеси может быть задан массовыми или объемными долями.
Массовой долей какого-либо газа в смеси называется отношение массы данного газа к суммарной массе всей смеси:
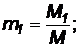
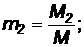 ….
…. 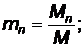 (8)
(8)
где М1, M2, … Мn - массы газов, входящих в смесь,
М - масса всей смеси.
Сумма массовых долей всех газов, входящих в смесь, равна единице:
m1+m2+ … +mn =1 (9)
Объемной долей газа, входящего в смесь, называется отношение объема данного газа, приведенного к давлению и температуре смеси, к объему всей смеси:
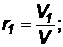
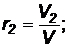 …
… 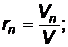 (10)
(10)
где V1; V2 … Vn – приведенные (парциальные) объемы газов, входящих в смесь;
V – объем смеси газов.
Давление смеси газов в соответствии с законом Дальтона равно сумме парциальных давлении, составляющих смесь газов:
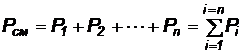 (11)
(11)
Для газовых смесей, в которых газы не входят в химические соединения, определяется условная величина "кажущаяся молекулярная масса" по объемным или массовым долям:
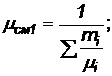
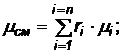 (12)
(12)
Зная кажущуюся молекулярную массу смеси, можно определить газовую постоянную смеси:
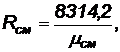 Дж/(кг .К) (13)
Дж/(кг .К) (13)
Зависимость между объемными и массовыми долями определяется соответственно:
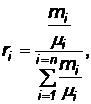
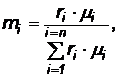 (14)
(14)
Теплоемкость газов.
Теплоемкостью газов называется количество тепла, необходимое для повышения температуры газа на один градус:
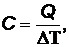 Дж/К (15)
Дж/К (15)
В расчетах обычно используется удельная теплоемкость, под которой понимается количество тепла, необходимое для повышения температуры количественной единицы газа на один кельвин, на практике такими единицами могут быть:
единица массы – кг,
единица объема – м3 и один моль.
В соответствии с этим различают теплоемкости:
массовую, объемную и мольную.
Удельная массовая теплоемкость - теплоемкость единицы массы газа, т.е. количество тепла, которое необходимо сообщить одному килограмму массы газа, чтобы его температура изменилась на один кельвин:
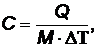 Дж/(кг. К) (16)
Дж/(кг. К) (16)
или, обобщая:
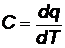 (17)
(17)
эта величина называется истинной теплоемкостью.
Объемной теплоемкостью называется количество тепла, которое необходимо сообщить массе вещества объемом V, чтобы изменить температуру на один кельвин:
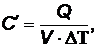 Дж/(м3. К) (18)
Дж/(м3. К) (18)
Так как в объеме в зависимости от параметров газа может содержаться различное количество вещества, то принято относить объем к нормальным физическим условиям: (Р =760 мм рт. ст.== 101325 Па; Т = 273 К или t=0 °С).
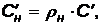 Дж/(м3. К) (19)
Дж/(м3. К) (19)
Мольной теплоемкостью называется теплоемкость моля газа:
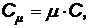 Дж/(моль·К) (20)
Дж/(моль·К) (20)
Средней теплоемкостью газа за процесс в пределах температур от t1 до t2 называется отношение количества тепла, которое необходимо сообщить газу для повышения его температуры от t1, до t2, к разности этих температур:
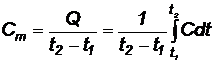 (21)
(21)
Теплоемкость зависит от массы, химического состава, термодинамического состояния вещества (Р, t), условий протекания процесса подвода или отвода тепла. Для идеального газа теплоемкость не зависит от давления.
Как общее явление, с повышением температуры газов теплоемкость газов возрастает, эта зависимость выражается формулой:
C=a+вt+dt2, (22)
где а, в, d - постоянные, зависящие от природы газа и характера процесса.
Изменение температуры тела зависит не только от количества сообщенного тепла, но и от процесса, при котором подводится тепло. В технике наиболее часто тепло подводится к газу двумя способами: при постоянном объеме и постоянном давлении. Соответственно различают теплоемкость при постоянном объеме 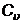 и постоянном давлении
и постоянном давлении 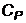 .
.
Подставим в формулу (17) значение q по первому закону термодинамики:
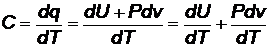 (23)
(23)
Первый член этого выражения характеризует изменение внутренней энергии, а второй - работу расширения одного килограмма газа при изменении его температуры на один кельвин. Последний член называется удельной работой и обозначается h, Дж/кг:
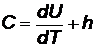 (24)
(24)
Дата добавления: 2018-08-06; просмотров: 2179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
