Общая характеристика класса оксидоредуктаз. Коферменты и простеические группы оксидоредуктаз. Привести конкретные примеры метаболических реакций с участием дегидрогеназ и оксидаз.
Оксидоредуктазы - Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД,НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Если рассматривать все подклассы, то в них выделяются группы ферментов, действующие на:
1.1. CH-OH группу доноров;
1.2. альдегидную или кетоновую группу доноров;
1.3. CH-СH группу доноров;
1.4. CH-NH2 группу доноров;
1.5. CH-NН группу доноров;
1.6. НАДH или НАДФН в качестве доноров;
1.8. содержащие серу группы доноров;
1.9. гем-содержащие доноры;
1.10. дифенолы в качестве доноров;
1.11. пероксид водорода в качестве акцептора;
1.11. водород в качестве донора;
1.13. один донор с включением молекулярного кислорода;
1.14. два донора с включением молекулярного кислорода;
1.15. супероксидные радикалы в качестве акцептора;
1.17. СН2 группу доноров;
1.18. ферредоксин в качестве донора;
1.19. флаводоксин в качестве донора;
1.20. фосфор или мышьяк в качестве донора;
1.21. на вещества Х-Н и Y-Н с образованием X-Y-связи;
1.22. галоген в качестве донора;
1.97. другие оксидоредуктазы.
На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+ (1.1.1., 1.2.1., 1.3.1., 1.4.1.), дисульфиды (1.2.4.), кислород (1.3.3.). Например, каталаза (КФ 1.11.1.6), пероксидаза (КФ 1.11.1.7).
|
|
|
Наиболее распространены следующие рабочие названияоксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.

Характеристика фермента
| Систематическое название | Сукцинат:ФАД-оксидоредуктаза |
| Рабочее название | Сукцинатдегидрогеназа |
| Класс | 1. Оксидоредуктазы |
| Подкласс | 1.3. Действующие на СН-СН-группу доноров |
| Подподкласс | 1.3.99. с ФАД+ в качестве акцептора |
| Кофакторы | Флавинадениндинуклеотид |
|
|
|

Характеристика фермента
| Систематическое название | Фенилаланин.Тетрагидробиоптерин:кислород-оксидоредуктаза |
| Рабочее название | Фенилаланин-4-монооксигеназа Фенилаланин-гидроксилаза |
| Класс | 1. Оксидоредуктазы |
| Кофакторы | Тетрагидробиоптерин. Железо. |
Общая характеристика класса трансфераз. Коферметны трансфераз. Привести конкретные примеры метаболических реакций с участием трансфераз. Диагностическое значение определения аминотрансфераз в сыворотке крови.
Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп.
Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.
|
|
|
Если рассматривать все подклассы, то в них выделяются группы ферментов в зависимости от состава переносимой группы
2.1. переносящие одноуглеродные фрагменты;
2.2. переносящие альдегидные и кетогруппы;
2.3. переносящие ацильные группы;
2.4. переносящие гликозильные группы;
2.5. переносящие неметильные алкильные и арильные группы;
2.6. переносящие азотсодержащие группы;
2.7. переносящие фосфорсодержащие группы.
2.8. переносящие сульфосодержащие группы;
2.9. переносящие селенсодержащие группы.
Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы.
Систематическое название образуется:
Донор группы : акцептор группы – переносимая группа трансфераза.
Пример 1

Характеристика фермента
| Систематическое название | АТФ:D-гексоза-6-фосфотрансфераза |
| Рабочее название | Гексокиназа |
| Класс | 2. Трансферазы |
| Кофакторы | Магний |
Пример 3
Характеристика фермента
| Систематическое название | L-Аспартат:2-оксоглутарат-аминотрансфераза |
| Рабочее название | Аспартатаминотрансфераза |
| Класс | 2. Трансферазы |
| Кофактор | Пиридоксальфосфат |
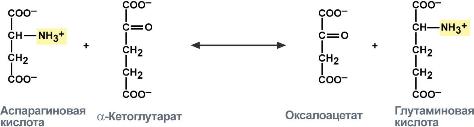
Аминотрансферазы (трансаминазы) — ферменты, катализирующие межмолекулярный перенос аминогруппы от соответствующих аминокислот на a‑кетокислоты (2‑оксокислоты) с образованием новых кето- и аминокислот без образования свободного аммиака, в качестве кофермента используется витамин В6 (пиридоксин). Эти ферменты играют центральную роль в обмене белков, осуществляя окислительное дезаминирование аминокислот опосредованно через глутаминовую кислоту. Образующаяся глутаминовая кислота дезаминируется глутаматдегидрогеназой с освобождением свободного аммиака и 2‑оксоглутаровой кислоты.
|
|
|
В организме наибольшее значение имеют две аминотрансферазы: аспартатаминотрансфераза (АСТ или АсАТ) и аланинаминотрансфераза (АЛТ или АлАТ). В клинической практике чаще всего определяют именно активность этих двух ферментов. Реакции, катализируемые этими ферментами:
2-Оксоглутарат + Аспартат ↔ Глутамат + Оксалоацетат
2-Оксоглутарат + Аланин ↔ Глутамат + Пируват
Наибольшая активность АСТ обнаружена в миокарде, затем в порядке убывания в печени, скелетных мышцах, головном мозге, почках. Активность фермента в миокарде в 10000 раз выше, чем в сыворотке крови. Активность АЛТ максимальна в печени, среди других органов убывает в последовательности: поджелудочная железа, сердце, скелетные мышцы, селезенка, легкие. Избирательная тканевая локализация позволяет считать трансаминазы маркерными ферментами: АСТ для миокарда, АЛТ для печени. Соотношение активности аминотрансфераз позволяет судить о глубине повреждения клеток: АЛТ преимущественно локализована в цитоплазме, АСТ — в цитоплазме и в митохондриях.
Клинико‑диагностическое значение
Определение активности АСТ и АЛТ является чувствительным тестом для диагностики инфаркта миокарда, который не выявляется на ЭКГ, активность АСТ возрастает через 4‑6 часов от начала ангинального приступа, спустя 24‑36 часов достигает максимума и нормализуется на 3‑7 день. Вторичное повышение свидетельствует о повторном инфаркте. Особенно важное значение имеет определение активности аминотрансфераз для диагностики заболеваний печени. Некроз или повреждение печеночных клеток любой этиологии (острый и обострения хронического гепатита, холестатическая и обтурационная желтуха, лекарственно-индуцированное поражение) сопровождаются повышением активности обоих ферментов, преимущественно АЛТ, коэффициент де Ритиса = АСТ/АЛТ < 1,33. Уже в продромальном периоде болезни Боткина и у больных с безжелтушной формой гепатита активность АЛТ достоверно возрастает.
Общая характеристика класса гидролаз (эстеразы, протеиназы, глюзидазы, аминазы, амидазы). Привести конкретные примеры метаболических реакций с участием гидролаз. Указать применение гидролаз в ветеринарной и медицинской практике.
Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате путем присоединения элементов Н2О, подразделяются на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют.
Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры.
Исторически названия гидролаз складывались из названия субстрата с окончанием "‑аза" – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз:
1. Эстеразы – гидролиз сложноэфирных связей.
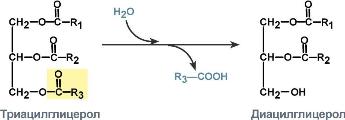
2. Липазы – гидролиз нейтральных жиров (триацилглицеролов).
3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты.
4. Гликозидазы – гидролизуют О- и S-гликозидные связи.
5. Протеазы, пептидазы – гидролиз белков и пептидов.
6. Нуклеазы – гидролиз нуклеиновых кислот.
Гидролизуемый субстрат : отделяемая группа гидролаза.
Пример 1
Характеристика фермента
| Систематическое название | Триацилглицерол:ацилгидролаза |
| Рабочее название | ТАГ-липаза |
| Класс | 3. Гидролазы |
| Подкласс | 3.1. эстераза |

Характеристика фермента
| Систематическое название | α-D-глюкозид:глюкогидролаза |
| Рабочее название | Мальтаза |
| Класс | 3. Гидролазы |
| Подкласс | 3.2. Гликозидазы |

Характеристика фермента
| Систематическое название | Ацетилхолин:ацетил-гидролаза |
| Рабочее название | Холинэстераза |
в медицине: - гидролазы используются
Пепсин, трипсин, панкреатин применяются при гастритах, при резекции желудка, когда вырабатывается недостаточное количество фермента; - для растворения тромба при тромбофлебитах, инфаркте миокарда. Стрептокиназа для введения через катетер в сосуды сердца для растворения тромбов; - для рассасывания гематом при операциях на лице, травмах (в виде таблеток, мази, содержащих гидролазы). - для рассасывания воспалительных экссудатов при воспалении легких, абсцессах легкого, плевритах, пиелонефритах. - в стоматологии при обработке десневых карманов при парадонтозе.
Дата добавления: 2018-08-06; просмотров: 3205; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
