Внутренняя энергия идеального одноатомного газа. Зависимость энергии от макроскопических параметров. Число степеней свободы. Внутренняя энергия многоатомного газа.
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы.
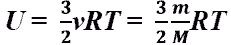 Внутренняя энергия идеального газа(для одноатомного идеального газа)
Внутренняя энергия идеального газа(для одноатомного идеального газа)
Число степеней свободы — это число независимых переменных, полностью определяющих положение молекулы как системы атомов в пространстве.
| Газ | одноатомный | двухатомный | трехатомный | |
| Число степеней свободы | поступательных | 3 | 3 | 3 |
| вращательных | — | 2 | 3 | |
| всего | 3 | 5 | 6 |
Закон Больцмана о равномерном распределении энергии по степеням свободы молекулы:
На каждую степень свободы молекулы приходится в среднем одинаковая энергия
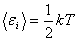 , где
, где
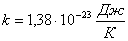 — постоянная Больцмана,
— постоянная Больцмана,
Таким образом, средняя кинетическая энергия одной молекулы газа 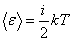 , где
, где
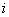 — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы.
— сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы. 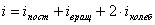 .
.
На колебательную степень свободы приходится вдвое большая энергия потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы.
Внутренняя энергия газа, содержащего 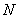 частиц, количеством
частиц, количеством 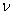 молей и массой
молей и массой 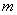 :
:
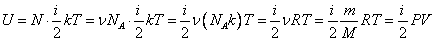
Зависимость внутренней энергии от макроскопических параметров. Внутренняя энергия идеального газа зависит от одного параметра - температуры. Средняя потенциальная энергия взаимодействия молекул газа зависит от объема вещества, так как при изменении объема меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия реального газа в термодинамике в общем случае зависит, наряду с температурой T, и от объема V. Значения макроскопических параметров (температуры T, объема V и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел. Внутренняя энергия U макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объемом. Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
|
|
|
Работа в термодинамике. Изменение внутренней энергии при совершении работы. Геометрическое истолкование работы.
Величина работы газа равна площади фигуры под графиком на диаграмме pV.
Формулы для вычисления работы при постоянном давлении:
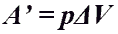 - Работа газа при изобарном процессе (p = const)
- Работа газа при изобарном процессе (p = const) 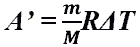
Внутреннюю энергию тела можно увеличить, совершая над телом работу. Если же работу совершает само тело, то его внутренняя энергия уменьшается.
Количество теплоты. Теплоёмкость идеального газа. Удельная теплоемкость вещества. Молярная теплоемкость. Удельная теплоемкость парообразования, плавления. Изменение внутренней энергии.
|
|
|
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c = Q / (mΔT). Во многих случаях удобно использовать молярную теплоемкость C = M · c, где M – молярная масса вещества.
Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
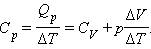
|
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ. 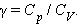
|
|
|
Уде́льная теплота́ испаре́ния (удельная теплота парообразования) — физическая величина, показывающая количество теплоты, которое необходимо сообщить 1 кг вещества, взятому при температуре кипения, чтобы перевести его из жидкого состояния в газообразное. Удельная теплота испарения измеряется в Дж/кг.
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества).
Дата добавления: 2018-08-06; просмотров: 1240; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
