Взаимные превращения жидкостей и газов. Насыщенный пар. Испарение и конденсация. Кипение. Влажность воздуха. Психрометр. Фазовая диаграмма воды. Критическая и тройная точки воды.
Основные положения МКТ. Кол-во вещества. Число Авогадро. Молярная масса. Диффузия. Броуновское движение. Силы взаимодействия между молекулами.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
ЧИСЛО АВОГАДРО - постоянная, равная 6,02223 10^23, соответствует числу атомов или молекул, содержащихся в одном МОЛЕ вещества.
|
|
|
М - масса одного моля данного вещества. Вычисляется по таблице Менделеева, в которой массовое число численно равно молярной массе в граммах на моль.
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества.
Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в жидкости или газе(1827г)
Идеальный газ. Давление газа. Единицы давления. Манометр, барометр. Среднее значение квадрата скорости молекул. Основное уравнение МКТ. Связь давления со средней кинетической энергией.
Идеальный газ - модель реального газа, которая удовлетворяет следующим требованиям:
§ Расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
§ Силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
§ Столкновение молекул друг с другом и со стенками абсолютно упругое;
§ Движение каждой молекулы подчиняется классическим законам динамики Ньютона.
Давление газов на стенки сосуда объясняется ударами молекул.
Единицы измерения давления: Паскаль (ньютон на квадратный метр,) Бар, Миллиметр ртутного столба (торр), атмосфера.
|
|
|
Манометр — прибор, измеряющий давление жидкости или газа
Принцип действия манометра основан на уравновешивании измеряемого давления силой упругой деформации трубчатой пружины или более чувствительной двухпластинчатой мембраны, один конец которой запаян в держатель, а другой через тягу связан с трибко-секторным механизмом, преобразующим линейное перемещение упругого чувствительного элемента в круговое движение показывающей стрелки
В жидкостных барометрах давление измеряется высотой столба жидкости (ртути) в трубке, запаянной сверху, а нижним концом опущенной в сосуд с жидкостью (атмосферное давление уравновешивается весом столба жидкости). Ртутные барометры — наиболее точные, используются на метеостанциях.
Средний квадрат проекции скорости равен 1/3 среднего квадрата самой скорости. Множитель 1/3 появляется вследствие трехмерности пространства. 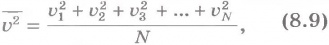
Основное уравнение МКТ 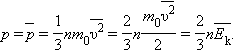 (E=3/2kT)
(E=3/2kT)
Температура и тепловое равновесие. Температура – мера средней кинетической энергии. Абсолютный нуль. Постоянная Больцмана. Измерение температуры. Термометрия. Температурные шкалы. Контактные и бесконтактные термометры. Измерение скоростей молекул газа (СРС).
|
|
|
Состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды, называется тепловым равновесием. Температура характеризует степень нагретости тела. Она является макроскопическим параметром, характеризующим тепловое равновесие систем тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру, а другие макроскопические параметры (р, V, т) могут быть различны.
Температура служит мерой средней кинетической энергии молекул: 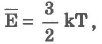
k - постоянная Больцмана, k = 1,38 • 10-23Дж/К
Методы измерения различны для разных диапазонов измеряемых температур и зависят от условий измерений и требуемой точности. Их можно разделить на две группы: контактные и бесконтактные. При контактных методах прибор, измеряющий температуру среды, должен находиться с нею в тепловом равновесии, т. е. иметь с нею одинаковую температуру, а при бесконтактных - путем опосредованных измерений. Термометрия тела — измерение температуры тела.
Температура измеряется термометрами, которые могут быть градуированы по разным шкалам. Международной шкалой является абсолютная температурная шкала. Кроме этого широко используется шкала Цельсия. Абсолютный нуль температуры расположен на 273,15 °С ниже нуля температуры по шкале Цельсия. С приближением температуры к абсолютному нулю стремится к нулю теплоемкость, коэффициент теплового расширения и др. По представлениям классической физики при абсолютном нуле температур энергия теплового (хаотического) движения молекул и атомов вещества равна нулю.
|
|
|
Средняя скорость теплового движения молекул 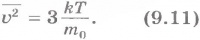
Макроскопические и микроскопические параметры. Уравнение состояния идеального газа. Универсальная газовая постоянная. Изотермический, изобарный, изохорный процесс. Аномальный свойства воды.
Микроскопическое состояние (или микросостояние) — это состояние системы, определяемое заданием координат и импульсов всех составляющих систему частиц.
Макроскопическое состояние (или макросостояние) — это состояние системы, характеризуемое небольшим числом величин (Р, V, T) и, быть может, еще некоторыми другими).
Произведение постоянной Авогадро Nа на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = 8,31 Дж/моль·К.
 - уравнение состояния идеального газа.
- уравнение состояния идеального газа.
Вода является легчайшим соединением подгруппы кислорода. Самыми высокими у воды характеристиками оказываются как раз те, которые по сути должны быть самыми низкими: температура кипения и температура замерзания, теплота парообразования, теплота плавления и т.д. Именно благодаря способности воды накапливать достаточно большие запасы тепловой энергии сглаживают резкие колебания температуры на земной поверхности. Еще одним аномальным явлением воды является высокое поверхностное напряжение.
а)Изотермический процесс -это процесс, происходящий в физической системе при постоянной температуре (T = const). При постоянной температуре dU =0, поэтому все сообщаемое системе количество теплоты расходуется на совершение работы против внешних сил.
Изотермический процесс : dQ = dA
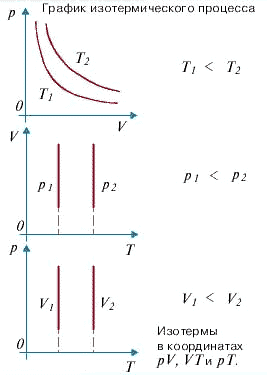
б) Изохорный процесс -это процесс, происходящий в физической системе при постоянном объёме (V = const). Так как V = const, то dV =0, а следовательно, и dA = pdV = 0. Вся теплота, сообщенная газу при изохорном процессе, идет на увеличение его внутренней энергии.
Изохорный процесс : dQ = dU ; CvdT = dU (Cv - молярная теплоемкость газа при постоянном объеме)
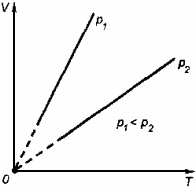
в) Изобарный процесс -это процесс, происходящий в физической системе при постоянном давлении (p = const). При этом изменяются объем и температура, следовательно, совершается работа dA = pdV и изменяется внутренняя энергия dU.
Изобарный процесс : dQ = dU+pdV
При изобарном процессе dQp = CpdT, поэтому первое начало термодинамики примет вид:
CpdT = CvdT + pdV
Уравнение состояния для моля идеального газа: pV = RT
Для изобарного процесса это уравнение примет вид : pdV = RdT
Соотношения Cp = Cv+R или Cp-Cv = R называют уравнением Майера.
Строение газообразных, жидких и твердых тел. Кристаллические, аморфные тела. Анизотропия кристаллов. Моно- и поликристаллы. Температура плавления, затвердевания. Возгонка (сублимация, десублимация). Тепловое расширение жидких и твердых тел. Коэффициент линейного расширения.
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу), поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения равновесия, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия.
Твердые тела. Атомы или молекулы твердых тел, в отличие от атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму. Потенциальная энергия взаимодействия молекул твердого тела существенно больше их кинетической энергии.
У газа расстояние l между молекулами много больше размеров молекулr0:'l>>r0.
У жидкостей и твердых телl≈r0. Молекулы жидкости расположены в беспорядке и время от времени перескакивают из одного оседлого положения в другое.
У кристаллических твердых тел молекулы (или атомы) расположены строго упорядоченно.
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl. Такие кристаллы называются ионными.
Неодинаковость свойств кристалла в различных направлениях называют анизотропией.
ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ (точка затвердевания) – температура, при которой жидкость превращается в твердое вещество. Для чистого вещества совпадает с его температурой плавления, т.е. температурой перехода из твердого состояния в жидкое.
Возгонка(сублимация) - переход в-ва из тв. состояния в газообразное, минуя жидкую фазу. Десублимация – наоборот.
Коэффициент теплового расширения — величина, характеризующая относительную величину изменения объёма или линейных размеров тела с увеличением температуры на 1 К при постоянном давлении
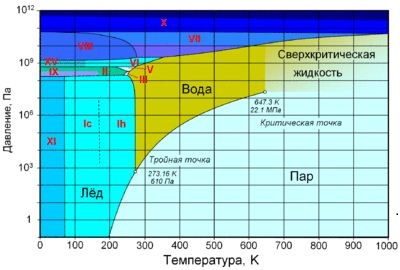
Взаимные превращения жидкостей и газов. Насыщенный пар. Испарение и конденсация. Кипение. Влажность воздуха. Психрометр. Фазовая диаграмма воды. Критическая и тройная точки воды.
Между жидкостью и паром, находящимся над ней может существовать динамическое равновесие, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся их пара в жидкость за то же время. Пар, находящийся в равновесии со своей жидкостью называют насыщенным. Давление насыщенного пара не зависит от объема и определяется только темературой.
Жидкость кипит при температуре, при которой давление насыщенного пара в пузырьках становится равным давлению в жидкости. Чем больше внешнее давление, тем выше температура кипения
С увеличением температуры плотность насыщенного пара растет, а плотность жидкости уменьшается. При температуре, называемой критической, исчезают различия между жидкостью и ее насыщенным паром. Их плотности становятся одинаковыми. Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара.
Кипение - это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё.
Психро́метр — прибор для измерения влажности воздуха и его температуры.
Скорость испарения влаги увеличивается по мере уменьшения относительной влажности воздуха. Испарение влаги, в свою очередь вызывает охлаждение объекта, с которого влага испаряется. По мере охлаждения влажного объекта уменьшается и скорость испарения влаги до тех пор пока при некоторой температуре не будет достигнуто динамическое равновесие - количество испарившейся влаги сравняется с количеством конденсирующейся. Таким образом температура влажного объекта (например термометра, обёрнутого во влажную ткань) даёт информацию об относительной влажности воздуха. Простейший психрометр состоит из двух спиртовых термометров, один - обычный сухой термометр, а второй имеет устройство увлажнения. Термометры имеют градуировку с ценой деления 0,1-0,5 градуса. Термодатчик влажного термометра обернут хлопчатобумажной тканью, которая находится в сосуде с водой. Вследствие испарения влаги, увлажнённый термометр охлаждается. Для определения относительной влажности снимают показания с сухого и влажного термометров, а далее используют Психрометрическую таблицу. Обычно входными величинами в Психрометрической таблице являются показания сухого термометра и разница температур сухого и влажного термометров.
Относительная влажность — это отношение плотности водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной температуре, выраженное в процентах.
Тройная точка воды - строго определенные значения температуры и давления, при которых вода может одновременно существовать в твердом, жидком и газообразном состояниях.
Критическая точка – сочетание значений температуры и давления, при которых исчезает различие в свойствах жидкой и газообразной фаз вещества. Критическая точка для воды достигается с большим трудом при температуре 374,2° С и давлении 21,4 МПа.
Фа́зовая диагра́мма воды — графическое отображение равновесного состояния фаз воды (жидкости, водяного пара и различных модификаций льда). Строится в системе координат температура—давление.
Дата добавления: 2018-08-06; просмотров: 355; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
