Семинар 9. Электролиз расплавов и
Растворов солей
4 часа
Цель семинара:
1. Изучить законы электролиза, механизм электролиза расплавов и растворов солей.
2. Научиться писать ОВР, протекающие на электродах в процессе электролиза, решать расчетные задачи с использованием законов электролиза.
План занятия
1. Изучение основных законов электролиза.
2. Изучение ОВР, протекающих на электродах при электролизе водных растворов солей.
3. Решение расчётных задач.
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007.- с.120-141.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 138-160.
Дополнительная литература
1. Болдырев А.И. Физическая и коллоидная химия. – М.: Высшая школа, 2003.
2. Киреев В.А. Курс физической химии. – М.: Химия, 1995.
3. Физическая химия. [Учебн.]/ К.С. Краснов, Н.К. Воробъёв, И.Н. Годнев и др., под ред. К.С. Краснова.-М.: Высшая школа, 1995.
4. Фиошин М.Я., Павлов В.В. Электролиз в неорганической химии. – М.: Наука, 1996.
Методические рекомендации
Тема «Электролиз» изучается в школьном курсе химии, поэтому при подготовке к семинару необходимо детально знать сущность процесса электролиза расплавов и растворов солей. Уметь сформулировать законы электролиза и привести их математическое выражение. Научиться использовать эти законы для решения расчетных задач. Изучить сущность перенапряжения и его виды, практическое значение перенапряжение водорода.
|
|
|
Вопросы для самоподготовки
1. Что такое электролиз? Его практическое значение.
2. Раствор содержащий по 0,1 моль нитрата цинка, нитрата меди (II) и нитрата свинца (II), подвергается электролизу. В какой последовательности будут разряжаться ионы на катоде?
3. Можно ли получить любой металл при электролизе водного раствора его соли?
4. Составьте схемы электролиза водного раствора и расплава хлорида натрия.
5. Какие процессы протекают у электродов при электролизе раствора хлорида меди (II) с платиновыми и с медными электродами?
6. Через растворы хлорида калия и сульфата калия в течение некоторого времени пропускали электрический ток. Покажите, изменилось ли содержание соли в растворе, составив схемы электролиза этих солей.
7. Сформулируйте законы Фарадея. Напишите и поясните уравнение, объединяющее оба закона.
8. Что такое коэффициент пропорциональности в I законе Кулона? Одинаков ли он будет у железа в солях FeCl3 и FeCl2?
9. Что такое выход по току? Почему введено это понятие?
10. Что такое поляризация? Какие существуют виды поляризации? Способы устранения поляризации.
11. Что такое напряжение разложения? Изобразите и поясните кривую напряжения разложения.
|
|
|
12. Почему кислородосодержащие кислоты и щелочи разлагаются почти при одном и том же напряжении разложения? Рассмотрите на примерах.
13. Объясните, почему у различных кислородосодержащих кислот напряжение разложения одно и почти одинаковое, а у безкислородных кислот – другое. Разберите на примерах.
14. Как измеряется скорость электрохимической реакции?
15. В чем заключается различие между химическими реакциями и реакциями электрохимическими?
16. В чем состоит сущность диффузионного перенапряжения? Напишите уравнение диффузионного перенапряжения.
17. Напишите стадии гетерогенной электрохимической реакции разряда и выделения кислорода на катоде.
18. Что такое перенапряжение перехода, катодное и анодное перенапряжение? Напишите соответствующие уравнение.
19. От каких факторов зависит перенапряжение на электроде?
20. Как зависит перенапряжение водорода от природы металла и от плотности тока?
Задачи для самостоятельного решения
1. Ток силой 1,2 А проходит через раствор хлорида меди (II) в течении 2 ч. Сколько меди выделится на катоде?
2. Через раствор сульфата натрия в течение 10 мин пропускают ток силой 0,5 А. какие продукты и в каких количествах образуются на катоде и аноде, если электроды платиновые, а анодное и катодное пространство разделены диафрагмой?
|
|
|
3. При прохождении тока через раствор гидроксида натрия в течение 2 мин выделился при 18°С и давлении 98,6 кПа водород объемом 30 см3. найдите силу тока.
4. Ток силой 1,5 А выделяется из раствора сульфата кадмия в течение 40 мин кадмий массой 2,283 г. Вычислите молярную массу эквивалента этого металла. Какое вещество и какой массы выделилось на угольном аноде при нормальных условиях?
5. Какое количество надо пропустить через раствор для никелирования, чтобы утюг поверхностью 500 см2 покрылся слоем никеля толщиной 0,015 мм, если плотность никеля равна 8,8 г/см3?
6. Сколько времени надо пропускать ток силой 1 А через раствор нитрата серебра, чтобы покрыть предмет, поверхность которого равна 150 см2, слоем серебра толщиной 0,01 мм? Плотность серебра равна 10,5 г/см3.
7. Через раствор сульфата меди (II), в который опущены медные электроды, в течение 3 ч. пропускали ток силой 1,5 А. Какие процессы происходили у анода и катода? Как изменилась масса анода?
8. При рафинировании меди из раствора выделяется медь массой 338 г при расхождении 1080 кКл электричества. Вычислите выход по току.
9. Металлический кальций получается электролизом расплавленного хлорида кальция. Вычислите выход по току, если при прохождении 20,8 МКл электричества выделился кальций массой 4,48 кг. Подсчитайте также, сколько электроэнергии затрачивается на получение кальция массой 1 т, если напряжение на ванне составляет 25 В?
|
|
|
10. При электролизе раствора нитрата серебра мольной концентрации 0,05 моль/л на катоде выделилось серебро массой 0,3482 г. Убыль нитрата серебра в катодном пространстве при расчете на серебро составила 0,1858 г. Найти числа переноса для ионов Ag+ и NO 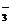 .
.
Дата добавления: 2018-08-06; просмотров: 192; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
