Задачи для самостоятельного решения
1. В воде объемом 200 мл растворен бромид калия массой 50 г. Плотность раствора равна 1,16 г/см3. Выразите состав раствора: а) в массовых долях; б) в молярных долях; в) в моляльности; г) молярную концентрацию эквивалента вещества.
2. В воде объемом 300 мл растворено 20 г медного купороса СuSO4∙5Н2О. Выразите состав раствора: а) в массовых долях; б) в молярных долях; в) в моляльности.
3. Давление пара над раствором, содержащим нафталин массой 2,55 г в бензоле массой 234 г, при 20 °С равно 99,53 гПа. Давление пара над чистым бензолом при этой температуре равно 100,21 гПа. Вычислите относительную молекулярную массу нафталина и относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
4. Вычислите давление пара над раствором, содержащим дифениламин (С6Н5)2NH массой 0,514 г в бензоле массой 50 г (раствор взят при 20 °С). Давление пара бензола при этой температуре равно
100,2 гПа.
5. Раствор, содержащий глюкозу массой 7,252 г в воде массой 200 г, замерзает при -0,378 °С. Криоскопическая постоянная воды равна 1,86 К∙кг/моль. Определите относительную молекулярную массу глюкозы и относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
6. Раствор салициловой кислоты в этиловом спирте кипит при температуре 78,584 °С. Температура кипения спирта равна 78,3 °С, а удельная теплота испарения его при этой температуре 853,5 Дж/г. Вычислите давление пара над раствором при 78,3 °С.
7. Сколько граммов нафталина растворено в хлороформе массой 50 г, если полученный раствор кипит при 62,234 °С? Температура кипения хлороформа 61,2 °С, а эбуллиоскопическая постоянная его 3,76 К∙кг/моль.
8. Определите осмотическое давление 5% раствора свекловичного сахара при 15 °С. Плотность раствора 1,019 г/см3.
9. Какова молярная концентрация раствора мочевины, если при 17 °С он производит давление, равное 86,6 кПа?
10. При 15,5 °С осмотическое давление раствора, содержащего в 1 л воды свекловичный сахар массой 9,968 г, равно 69,8 кПа. Вычислите величину константы R.
Семинар 6. Растворы электролитов
4 часа
Цель семинара:
1. Изучить теорию электролитической диссоциации Аррениуса и теорию сильных электролитов.
2. Научиться решать расчетные задачи связанные со степенью диссоциации, изотоническим и осмотическим коэффициентами.
План занятия
1. Изучение основ теории сильных электролитов.
2. Современны добавления к теории сильных электролитов.
3. Решение расчётных задач по теме семинара.
4. Подведение итогов семинара
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 71-90.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 90-101.
Дополнительная литература
1. Болдырев А.И. Физическая и коллоидная химия. - М.: Высшая школа, 2003.
2. Климов И.И., Филько А.И. Сборник вопросов и задач по физической и коллоидной химии. - М.: Просвещение, 2003.
3. Физическая химия / К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др. Под ред. К.С. Краснова. – М.: Высшая школа, 1995.
4. Чанг Р. Физическая химия с приложениями к биологическим системам. - М.: Мир,1990.
Методические рекомендации
При подготовке к теме семинара обратить особое внимание на теорию электролитической диссоциации Аррениуса и дополнения, внесенные туда Каблуковым. Необходимо также знать теорию сильных электролитов Дебая и Гюккеля и современные дополнения к ней. Усвоить новые понятия: активность, коэффициент активности, ионная сила раствора. Знать все формулы связывающие степень диссоциации и изотонический коэффициент, уметь написать математическое выражение ЗДМ для диссоциации слабых электролитов.
Вопросы для самоподготовки
1. В чем состоят отклонения растворов кислот, щелочей и солей от законов Рауля и Вант-Гоффа? Как объясняются эти отклонения? Кем дано это объяснение?
2. Что такое изотонический коэффициент? Каков его физический смысл? Как он может быть определен?
3. Какие наблюдения привели к созданию теории электролитической диссоциации?
4. Изложите сущность теории электролитической диссоциации Аррениуса. Какие дополнения были внесены в нее И.А. Каблуковым? К каким электролитам она применима?
5. Что такое степень электролитической диссоциации? Какими методами она определяется? Напишите соответствующие уравнения, применяемые для расчетов степени диссоциации, и поясните их. Как изменяется степень электролитической диссоциации с разбавлением электролита?
6. Изложите основные положения теории сильных электролитов. Укажите, какие факты привели к созданию этой теории.
7. Что такое кажущаяся степень электролитической диссоциации? Какие коэффициенты введены в теории сильных электролитов? Напишите и поясните математически выражения, применяемые для их расчетов.
8. При одинаковой ли температуре замерзнут растворы мочевины, уксусной кислоты, хлорида калия, хлорида кальция, и хлорида алюминия, если их концентрация равна 0,1 моль/л. Дайте объяснение.
9. Какая по величине получится относительная молекулярная масса для электролита, если ее рассчитать по формуле 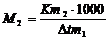 ? Дайте объяснение и укажите, где может быть использована эта величина.
? Дайте объяснение и укажите, где может быть использована эта величина.
10. Когда образуются ионы – при растворении вещества в воде или при пропускании через раствор электрического тока? Приведите факты, подтверждающие ответ.
11. Применим ли ЗДМ к сильным электролитам? Как это подтверждается экспериментально?
12. Выведите математическое выражение ЗДМ через степень электролитической диссоциации.
13. Что такое ионное произведение воды? Как оно определяется? Чему равна эта величина в воде и водных растворах?
14. Чему равна концентрация ионов водорода и гидроксида в нейтральной среде? Каковы значения концентрации иона водорода: а) в кислой среде; б) в щелочной среде?
15. Что такое рН? Какие значения он принимает в кислой, нейтральной и щелочной средах?
16. Почему для характеристики как кислотности, так и щелочности раствора применяется рН?
17. Как изменяется рН раствора, если к нему добавить раствор щелочи? Как нужно изменить концентрацию ионов водорода в растворе, чтобы рН его уменьшился?
18. Как изменяется степень диссоциации слабого электролита при добавлении к его раствору сильного электролита с одноименным ионом? Разберите на примерах.
19. Какие растворы (смеси) называются буферными? Приведите примеры.
20. Какими свойствами облагают буферные смеси? Докажите, что концентрация ионов водорода в буферной смеси почти не изменяется с разбавлением и мало изменяется при добавлении небольшого количества сильной кислоты или сильной щелочи.
21. Чему равна концентрация ионов водорода в ацетатной буферной смеси? Выведите соответствующую формулу.
22. Что такое буферная емкость? От чего она зависит? Как определяется на опыте?
23. Укажите, какое практическое значение имеют буферные смеси.
24. Что такое активность? Какое состояние электролита в растворе принято за стандартное?
25. Можно ли экспериментально определить активности отдельных ионов? Какой величиной активности для них обычно пользуются? Есть ли таблицы активности для отдельных ионов? Как они составлены?
26. Что такое коэффициент активности? Как его определяют?
27. Что такое ионная сила? Какое значение имеет эта величина для растворов электролитов?
Задачи для самостоятельного решения:
1. При 75 °С давление пара воды равно 385 гПа. Оно понизилось на 4,92 гПа при растворении в воде массой 100 г хлорида аммония массой 22 г. Вычислите кажущуюся степень диссоциации соли NН4С1 в этом растворе.
2. Вычислите давление пара раствора, содержащего в воде массой 44,7 г иодид кадмия массой 9,472 г при 80 °С. Степень диссоциации соли в этом растворе равна 32,6%. Давление пара воды при этой температуре 473 гПа.
3. Вычислите осмотическое давление при 17 °С раствора хлорида магния массовой долей 3,7%. Плотность раствора равна 1,03 г см3, а кажущаяся степень диссоциации соли 70,5%.
4. При 18 °С осмотическое давление раствора хлорида натрия молярной концентрации 0,5 моль/л равно 2,1∙106 Па. Вычислите кажущуюся степень диссоциации NaС1 в этом растворе.
5. Найдите молярную концентрацию раствора мочевины, который изотоничен с раствором хлорида бария молярной концентрации 0,01 моль/л при 20 °С. Кажущаяся степень диссоциации ВаС12 равна 87%.
6. При 17 °С осмотическое давление раствора сульфата калия молярной концентрации эквивалента 0,1 моль/л равно 300,8 кПа. Вычислите изотонический и осмотический коэффициенты.
7. Определите молярную концентрацию ионов А13+ и Cl- в растворе хлорида алюминия молярной концентрации эквивалента 0.1 моль/л, если кажущаяся степень диссоциации соли равна 65 %.
8. Вычислите молярную концентрацию эквивалента сульфата калия, если кажущаяся степень диссоциации соли в этом растворе 63%, а молярная концентрация иона К+ 0,315 моль/л.
9. Раствор, содержащий хлорид аммония массой 0,75 г в воде массой 100 г, кипит при температуре 100,128 °С. Вычислите кажущуюся относительную молярную массу и кажущуюся степень диссоциации хлорида аммония в этом растворе. Эбуллиоскопическая постоянная воды 0,512 К∙кг/моль.
10. Как изменится рН воды, если к 1 л ее прибавить: а) 1 моль едкого натра; б) 0,00126 г азотной кислоты? Диссоциацию электролитов считать полной.
11. Вычислите кажущуюся степень диссоциации раствора хлороводородной кислоты молярной концентрации 0,5 моль/л, если рН его равен 0,37.
12. Вычислите кажущуюся степень диссоциации раствора гидроксида бария молярной концентрации эквивалента 0,0156 моль/л, если рН его равен 12,16.
13. Определите рН буферной смеси, приготовленной сливанием 15 мл с (СН3СООН) = 0,5 моль/л с 25 мл с (СН3СООNa) = 0,2 моль/л. 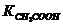 = 1,8∙10-5. Диссоциацию соли считать полной.
= 1,8∙10-5. Диссоциацию соли считать полной.
14. В каком соотношении нужно смешать раствор с (СН3СООН) = 0,4 моль/л с раствором с (СН3СООNa) = 0,1 моль/л, чтобы рН полученного раствора был равен 4,44? 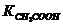 = 1,8∙10-5. Соль диссоциирует полностью.
= 1,8∙10-5. Соль диссоциирует полностью.
15. Сколько миллилитров раствора с (СН3СООН) = 0,2 моль/л нужно прибавить к 50 мл раствора с (СН3СООNa) = 0,25 моль/л, чтобы рН полученного раствора был равен 6?
16.Вычислите ионную силу раствора, содержащего следующие соли (в моль на 1 кг воды):
а) 0,01 моль NaCl; 0,2 моль ВаСl2 и 0,05 моль Аl(NO3)3;
б) 0,1 моль KNO3, 0,01 К2SО4 и 0,02 моль FeС13;
в) 0,05 моль СuSO4, 0,01 моль А1С13 и 0,2 моль Na2SO4;
г) 0,002 моль Zn(NO3)2, 0,05 моль NaNO3 и 0,001 моль А12(SО4)3.
17. Определите коэффициент активности иона Мg2+ в растворе, содержащем 0,004 моль MgCl2 и 0,002 моль А1С13 в 1 кг воды .
18. Определите коэффициент активности и активности иона Nа+ в растворе, содержащем 0,01 моль NаС1, 0,01 моль СuСl2 и 0,002 моль ZnSО4 в 1 кг воды .
19. Вычислите активность ионов в растворах: а) b (ВаС12/Н2О) = 0,002 моль/кг; б) b (Аl2 (SО4)3/Н2О) = 0,001 моль/кг.
20. Воспользовавшись уравнением Дебая и Гюккеля, вычислите средний коэффициент активности ионов и их активность в растворе b (СuСl2/Н2О) = = 0,001 моль/кг. А = 0,5117.
21. Применяя уравнение Дебая и Гюккеля, вычислите средний коэффициент активности К2SO4 в растворе, содержащем 0,001 моль К2SO4 и 0,002 моль MgCl2 в 1 кг воды. А = 0,5117.
22. Растворимость РbI2 в воде равна 1,4∙10-3 моль/л. Вычислите произведение растворимости этой соли с учетом коэффициентов активности.
 Семинар 7. Электропроводность растворов
Семинар 7. Электропроводность растворов
4 часа
Цель семинара:
1. Изучить способность различных веществ проводить электрический ток и зависимость электропроводности от различных факторов.
2. Научиться решать расчетные задачи связанные с расчетом электропроводности растворов.
План занятия
1. Изучение теоретических основ электропроводимости проводников второго рода.
2. Влияние различных факторов на электропроводимость.
3. Решение расчётных задач по теме семинара.
4. Подведение итогов семинара.
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 82-86, 94-105.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 110-121.
Дополнительная литература
1. Физическая химия. / Краснов К.С., Воробьев Н.К., Годнев И.Н. и др. Под ред. Краснова К.С. – М.: Высшая школа, 1995.
2. Физическая химия. / Б.П. Ни-кольский, Н.А. Смирнова, М.Ю. Панов и др.; Под ред. Б.П. Никольского. – М.: Химия, 2003.
3. Чанг Р. Физическая химия с приложениями к биологическим системам. - М.: Мир,1990.
Методические рекомендации
При подготовке к семинару следует обратить особое внимание на зависимость электропроводности от концентрации, температуры и индивидуальных свойств ионов. Необходимо уметь пояснить физический смысл чисел переноса, знать как их определяют опытным путем. В чём состоит сущность кондуктометрического титрования? Каковы его преимущества перед другими методами? На все эти вопросы необходимо дать обоснованный ответ.
Вопросы для самоподготовки
1. Почему металлы и растворы проводят электрический ток? К проводникам какого рода относятся расплавы солей?
2. От каких факторов зависит электрическая проводимость растворов? Поясните действие этих факторов.
3. Нарисуйте схему прибора, применяемого для определения сопротивления растворов; поставьте стрелками направление тока и напишите формулу, по которой рассчитывается неизвестное сопротивление.
4. Что такое постоянная сосуда? Как она определяется на опыте? Для чего она используется?
5. Что такое удельная электрическая проводимость? Укажите и объясните, как она изменяется с разбавлением. Начертите соответствующий график.
6. Что называется эквивалентной электрической проводимостью? Как она изменяется с разбавлением? Какое объяснение этого изменения дается для слабых и для сильных электролитов?
7. Как определяется эквивалентная электрическая проводимость при бесконечном разбавлении сильных и слабых электролитов?
8. Напишите и поясните математическое выражение закона Кольрауша.
9. Что такое абсолютная скорость иона? Как она определяется?
10. Что называется числом переноса? Как оно определяется? Для какой цели используется?
11. Для каких целей используется измерение электрической проводимости растворов?
12. Укажите и объясните, как изменяется электрическая проводимость при титровании сильной щелочью раствора: а) сильной кислоты, б) слабой кислоты, в) смеси сильной и слабой кислот.
13. Для какой цели поверхность электродов покрывают платиновой чернью?
14. Изменяется ли константа электролитической диссоциации с разбавлением раствора.
15. Что такое подвижность ионов? Какой физический смысл вкладывается в это понятие?
16. Что такое число гидратации иона? От каких факторов оно зависит?
17. Какие ионы называются структурирующими? Деструктирующими? Приведите примеры тех и других.
Дата добавления: 2018-08-06; просмотров: 182; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
