Ускоренный метод определения ХПК
1.В пробу сточной воды (в количестве 5мл) помещают в коническую колбу, добавляют 2,5 мл 0,25 н. раствора бихромата калия, 0,2 г сульфата ртути, при интенсивном перемешивании приливают 15 мл концентрированной серной кислоты. Температура реакционной смеси повышается до 100о С. Через 2 мин смесь охлаждают до комнатной температуры.
2. В колбу приливают 100 мл дистиллированной воды и титруют избыток бихромата калия 0,25 н. раствором соли Мора, в присутствии N- фенилантрониловой кислоты.
Химическое потребление кислорода, выраженное числом мг О2,/л, вычисляют по формуле :
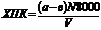
где а, в – объем раствора соли Мора, израсходованное на титрование в холостом опыте и пробы соответственно, мл; N – нормальность титрованного раствора соли Мора, экв/л; V – объем анализируемой сточной воды, мл; 8000 – молярная масса, в мг/л, ½ О2(с учетом размерности)..
Лабораторная работа № 11. Определение концентрации сульфат-ионов в воде
Цель работы: определить содержание сульфат-ионов в пробе анализируемой воды.
Теоретическое обоснование
По установленным стандартам содержание сульфат – ионов в воде источников централизованного водоснабжения не должно превышать 500 мг/л, но, как правило, в речной воде концентрация сульфат – ионов составляет не более 100-150 мг/л. Повышенная концентрация сульфатов может свидетельствовать о загрязнении источника сточными водами, в основном производственными.
|
|
|
Повышенное содержание сульфатов в воде ухудшает вкусовые свойства, увеличивает агрессивность.
Присутствуют практически во всех поверхностных водах и являются одним из важнейших анионов.
Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
2S + 3O2 + 2H2O = 2H2SO4.
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов и окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком.
В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства.
Ионная форма SO42- характерна только для маломинерализованных вод. При увеличении минерализации сульфатные ионы склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4, MgSO4.
Содержание сульфатных ионов в растворе ограничивается сравнительно малой растворимостью сульфата кальция (произведение растворимости сульфата кальция L=6,1.10-5). При низких концентрациях кальция, а также в присутствии посторонних солей концентрация сульфатов может значительно повышаться.
|
|
|
Сульфаты активно участвуют в сложном круговороте серы. При отсутствии кислорода под действием сульфатредуцирующих бактерий они восстанавливаются до сероводорода и сульфидов, которые при появлении в природной воде кислорода снова окисляются до сульфатов. Растения и другие автотрофные организмы извлекают растворенные в воде сульфаты для построения белкового вещества. После отмирания живых клеток гетеротрофные бактерии освобождают серу протеинов в виде сероводорода, легко окисляемого до сульфатов в присутствии кислорода.
Концентрация сульфата в природной воде лежит в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5–10 до 60 мг/дм3, в дождевых водах – от 1 до 10 мг/дм3. В подземных водах содержание сульфатов нередко достигает значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Важнейшим фактором, определяющим режим сульфатов, являются меняющиеся соотношения между поверхностным и подземным стоком. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
|
|
|
Повышенные содержания сульфатов ухудшают органолептические свойства воды и оказывают физиологическое воздействие на организм человека. Поскольку сульфат обладает слабительными свойствами, его предельно допустимая концентрация строго регламентируется нормативными актами. Весьма жесткие требования по содержанию сульфатов предъявляются к водам, питающим паросиловые установки, поскольку в присутствии кальция сульфаты образуют прочную накипь. Вкусовой порог сульфата магния лежит в пределах от 400 до 600 мг/дм3, для сульфата кальция – от 250 до 800 мг/дм3. Наличие сульфата в промышленной и питьевой воде может быть как полезным, так и вредным.
Существует много способов определения сульфат-ионов в воде. Наиболее распространенным является комплексометрический метод. Регламентирует определение содержания сульфат-ионов РД 52.24.57-88.
Для определения сульфатов во всех типах вод, включая морскую воду и большинство промышленных стоков, применяют гравиметрический метод по ИСО 9280. Данным методом определяют концентрации SO42- в диапазоне 10–5000мг/л при объеме пробы 10–200мл. Более высокие концентрации можно определить после разбавления пробы. Сущность метода заключается в осаждении сульфата в виде нерастворимой соли бария с последующим гравиметрическим определением.
|
|
|
Приборы, посуда, реактивы:конические колбы на 250 мл; бюретки; электрическая плитка; соляная кислота 0,1 н. раствор; хлорид бария, содержащий ионы магния (10 г BaCl2×2H2O и 4 г MgCl2×6H2O растворяют в 1 л дистиллированной воды); 0,1 н. раствор едкого натра; аммиачный буфер (20 г хлорида аммония, 100 мл 20%-ного раствора аммиака растворяют в дистиллированной воде, доводя объем до 1 л); эриохром черный Т ( 0,5 г индикатора и 10 мл аммиачного буферного раствора растворяют в этиловом спирте, доводя объем до 100 мл ); раствор ЭДТА 0,05 м; основной стандартный раствор сернокислого калия (0,9071 г К2SO4 растворяют в мерной колбе на 1л в дистиллированной воде и доводят объем до метки. 1мл раствора содержит 0,5 мг сульфат-иона); рабочий раствор сернокислого калия ( основной раствор разбавляют 1:10. 1мл раствора содержит 0,05 мг сульфат-иона; 5%-ный раствор хлористого бария (5г BaCl2×2H2O растворяют в дистиллированной воде и доводят объем до 100мл).
Дата добавления: 2018-08-06; просмотров: 923; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
