Требования к оформлению работы и выполнению заданий
1. Домашнюю контрольную работу обучающиеся выполняют самостоятельно, в отдельнойтетради, снумерацией страниц и соблюдением полей длязамечаний рецензента.
2. На титульном листе работы указывают шифр, курс, группу, наименование дисциплины, полностью фамилию, имя, отчество, номера заданий.
3. Текст работы грамотный, рукописный (почерк разборчивый) или печатный, сокращениясловне допускаются.
4. ДКР в соответствии с содержанием дисциплины состоит из пяти разделов (модулей) включающих 16 заданий. Вопросы заданий расположены после наименования изучаемой темы.
5. Задания домашней контрольной работы выполняют в порядке их нумерации. Для этого указывают номер модуля, тему и номер задания. Например: модуль 5 «Органические соединения», тема 14 «Кислородсодержащие соединения», задание №196. Затем переписывают вопросы и текст задания.
6. Ответы на вопросы задания приводят сразу после его текста, которые должны быть конкретными, не перегруженными второстепенным материалом. При этом записывают краткие, но четко обоснованные, ответы на теоретические вопросы, составляют уравнения реакций, расставляют в них коэффициенты и приводят соответствующие пояснения.
7. С решением задач знакомятся по учебным пособиям, учебникам и сборникам задач и упражнений по химии, а затем выполняют задания своего варианта.
8. Если по ходу решения приводят расчетную формулу, все входящие в нее величины необходимо расшифровать. Расчеты сопровождают кратким пояснением. В конце расчетов приводится ответ.
|
|
|
9. При выполнении заданий контрольной работы настоятельно рекомендуется воспользоваться методическими указаниями к выполнению каждого конкретного задания и вспомогательными таблицами, расположенными в Приложении методических указаний.
10. При написании работы необходимо использовать литературу, список которой приводят в конце работы (автор, название, издательство, год издания), после чего указывают дату выполнения работы и ставят подпись автора. В противном случае контрольная работа не рецензируется.
11. ДКР, не содержащую серьезных недочетов, рецензент подписывает с пометкой «к собеседованию», которое проводится в межсессионный период или во время сессии после того, как студент письменно ответит на все замечания рецензента. После собеседования рецензент выставляет зачет по контрольной работе и заносит его в ведомость.
12. Если работа возвращена, ее дорабатывают (с учетом замечаний), сдают, вновь регистрируют и на обложке помечают «повторно».
Варианты заданий для домашней контрольной работы
Модуль 1. Строение вещества
Тема 1-2. Основные законы химии, строение атома. Химическая связь
|
|
|
Контрольные задания 1 - 10
Вопросы заданий:
1. Указать положение элемента (А) в периодической системе Д.И. Менделеева.
2. Отметить состав атома и атомного ядра данного элемента. Составить электронную формулу элемента, определить его электронное семейство и химическую природу.
3. Перечислить характерные степени окисления элемента. Составить формулы его возможных оксидов и соответствующих им гидроксидов. Указать их названия и кислотно-основную природу.
4. Отметить значения относительной электроотрицательности элементов в соединениях (Б). Определить тип химической связи и указать, к какому элементу смещена общая электронная пара.
| № задания | Элемент | Соединения |
| А | Б | |
| 1. | Селен | O2, H2S, MgO |
| 2. | Стронций | AsH3, CaCl2, N2 |
| 3. | Бром | H2O, F2, AlF3 |
| 4. | Свинец | I2, SnCl2, CsBr |
| 5. | Медь | LiF, Cl2, Mg2Si |
| 6. | Хром | РH3, HI, NaCl |
| 7. | Марганец | F2, NH3, KBr |
| 8. | Олово | O2, HF, LiCl |
| 9. | Сера | N2, H2S, RbI |
| 10. | Фосфор | I2, SiH4, KF |
Контрольные задания 11 - 20
Вопросы задания:
1. Составьте молекулярные и структурные формулы перечисленных веществ и укажите, к каким классам неорганических соединений они относятся.
2. Укажите химическую природу оксидов и опишите их химические свойства.
|
|
|
3. Отметьте способы получения и характерные свойства гидроксидов (оснований).
4. Напишите формулы указанных кислот, отметьте их силу и приведите схемы их диссоциации. Назовите все кислотные остатки и составьте для каждого из них возможные формулы солей. Опишите химические свойства сильных кислот.
5. Отметьте типы указанных солей, назовите их по разным номенклатурам и составьте уравнения реакций перевода кислых и основных солей в соответствующие средние соли.
| № | Примеры соединений |
| 11. | Нитрат натрия, угольная кислота, гидроксид бериллия, гидроксохлорид алюминия, гидрокарбонат калия, диоксид серы, гидроксид калия, оксид меди(II). |
| 12. | Сероводородная кислота, оксид железа(II), гидросиликат натрия, гдроксонитрат магния, гидроксид бария, сульфид калия, гидроксид олова(II), оксид азота(III). |
| 13. | Диоксид кремния, гидроксид лития, сульфат алюминия, гидросиликат калия, марганцовистая кислота, гидроксосульфит кальция, гидроксид свинца(II), оксид кальция. |
| 14. | Борная кислота, оксид марганца(VI), иодид калия, гидроксид марганца(II), гидроксосульфат цинка, гидроксид кальция, дигидрофосфат натрия, оксид лития. |
| 15. | Оксид свинца(II), кремниевая кислота, гидроксид магния, дигидрофосфат калия, гидроксид алюминия, гидроксонитрат железа(II), арсенат натрия, оксид углерода(IV). |
| 16. | Азотистая кислота, оксид железа(III), сульфат магния, гидроксид никеля(II), гидросульфид бария, дигидроксонитрат хрома(III), гидроксид цинка, оксид бора(III). |
| 17. | Оксид азота(V), мышьяковая кислота, гидроксид кобальта(II), гидроксосульфит меди(II), гидросиликат кальция, гидроксид алюминия, фосфат натрия, оксид бария. |
| 18. | Хромовая кислота, гидрофосфат кальция, оксид серы(VI), арсенит цезия, гидроксид железа(II), гидроксохлорид висмута(III), гидроксид олова(II), оксид углерода(IV). |
| 19. | Диоксид кремния, хлорная кислота, перманганат калия, гидроксид кобальта(III), гидроксонитрат цинка, дигидроарсенит лития, гидроксид алюминия, оксид рубидия. |
| 20. | Хромат натрия, оксид марганца(VII), сернистая кислота, гидроксид меди(II), гидросиликат магния, гидроксид сурьмы (III), гидроксосульфат кобальта(III), оксид бериллия. |
Контрольные задания 21-40
|
|
|
Вопросы задания:
Вычислите эквиваленты и молярные массы эквивалентов элементов и соединений, выделенных курсивом, по формулам (А) и в химических реакциях (Б).
| № | (А) Вычисление по формулам |
| 21. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента N в его соединениях: N2O, N2O3, Mg(OH)2, HNO3, NaNO2 |
| 22. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента I в его соединениях: I2O5, I2O7, HIO2, NaIO3, Ni(OH)2 |
| 23. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента С в его соединениях: СО, СO2, Н2СO3, NaOH, Na2CO3 |
| 24. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Mn в соединениях: Mn2O3, Mn(OH)2, MnO2, HMnO4, K2MnO4. |
| 25. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Cr в соединениях: Cr2O3, CrO3, Cr(OH)3, H2CrO4, K2CrO4 |
| 26. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Cl в его соединениях: Cl2O3, Cl2O5, Al(OH)3, HClO4, KClO3 |
| 27. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Bi в его соединениях: BiCl3, Bi2O3, Bi(OH)3, HBiO3, NaBiO3 |
| 28. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента S в его соединениях: SO2, SO3, Ca(OH)2, H2SO3, CaSO4 |
| 29. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Br в его соединениях: Br2O, Br2O3, Fe(OH)2, HBrO3, NaBrO4 |
| 30. | Вычислить эквиваленты и молярные массы эквивалентов указанных веществ и элемента Sb в соединениях: Sb2O3, Sb2O5, Sb(OH)3, H3SbO4, Na3SbO4 |
| (Б) Вычисление по уравнениям | |
| 31. | Вычислить эквиваленты и молярные массы эквивалентов H3BO3 в реакциях: H3BO3 + КОН = KH2BO3 + H2O; H3BO3 + 2КОН = K2HBO3 + 2H2O; H3BO3 + 3KОН = K3ВO3 + 3H2O |
| 32. | Вычислить эквиваленты и молярные массы эквивалентов Сr(OH)3 в реакциях: Сr(OH)3 + 3НCl = CrCl3 + 3H2O; Сr(OH)3 + 2НCl = CrOHCl2 + 2H2O; Cr(OH)3 + HCl = Cr(OH)2Cl + H2O |
| 33. | Вычислить эквиваленты и молярные массы эквивалентов BiCI3 в реакциях: BiCl3 + KOH = BiOHCl2 + KCl; BiCl3 + 2KOH = Bi(OH)2Cl +2KCl; BiCl3 + 3KOH = Bi(OH)3 + 3KCl |
| 34. | Вычислить эквиваленты и молярные массы эквивалентов Fe(OH)3 в реакциях: Fe(OH)3 + НCl = Fe(OH)2Cl + H2O; Fe(OH)3 +2НCl = FeOHCl2 + 2H2O; Fe(OH)3 +3НCl = FeCl3 + 3H2O |
| 35. | Вычислить эквиваленты и молярные массы эквивалентов H3SbO4 в реакциях: H3SbO4 + КОН = KH2SbO4 + H2O; H3SbO4 + 2КОН = K2HSbO4 + 2H2O; H3SbO4 + 3КОН = K3SbO4 + 3H2O |
| 36. | Вычислить эквиваленты и молярные массы эквивалентов CoCl3 в реакциях: CoCl3 + KOH = CoOHCl2 + KCl; CoCl3 + 2KOH = Co(OH)2Cl +2KCl; CoCl3 + 3KOH = Co(OH)3 + 3KCl |
| 37. | Вычислить эквиваленты и молярные массы эквивалентов H3РO4 в реакциях: H3РO4 + КОН = KH2РO4 + H2O; H3РO4 + 2КОН = K2HРO4 + 2H2O; H3РO4 + 3КОН = K3РO4 + 3H2O |
| 38. | Вычислить эквиваленты и молярные массы эквивалентов Al(OH)3 в реакциях: Al(OH)3 + 3НCl = AlCl3 + 3H2O; Al(OH)3 + 2НCl = AlOHCl2 + 2H2O; Al(OH)3 + НCl = Al(OH)2Cl + H2O |
| 39. | Вычислить эквиваленты и молярные массы эквивалентов AlCl3 в реакциях: AlCl3 + 3KOH = Al(OH)3 + 3KCl; AlCI3 + 2KOH = Al(ОН)2Cl +2KCl; AlCl3+ KOH = AlОНCl2 + KCl |
| 40. | Вычислить эквиваленты и молярные массы эквивалентов H3AsO4 в реакциях: H3AsO4 + КОН = KH2AsO4 + H2O; H3AsO4+ 2КОН = K2HAsO4 + 2H2O; H3AsO4 + 3КОН = K3AsO4 + 3H2O |
Модуль 2. Основные закономерности протекания химических реакций
Тема 3.Основные законы термодинамики. Термодинамические потенциалы системы
Контрольные задания 41 – 60
| № | Содержание задания |
| 41. | При хранении муки моносахариды медленно окисляются кислородом воздуха с выделением тепла. Составьте уравнение данной реакции и рассчитайте её тепловой эффект (∆H0p), если стандартные теплоты образования равны: ∆Н0обр СО2 = -393,6 кДж/моль; ∆Н0обр Н2О = -285,9 кДж/моль; ∆Н0обр С6Н12О6 = -1272,5 кДж/моль. |
| 42. | При спиртовом брожении 0,5 моля глюкозы, происходящем при изготовлении теста, выделяется 35,1 кДж теплоты. Составьте уравнение данной реакции и вычислите теплоту образования глюкозы, если ∆Н0обр СО2 = -393,6 кДж/моль; ∆Н0обр С2Н5ОН = -277,9 кДж/моль; |
| 43. | Вычислить тепловой эффект реакции (∆H0p) С6Н12О6(т)=2С2Н5ОН(ж)+2СО2(г), используя следующие данные: ∆Н0сгорС6Н12О6(т) = -2815,8 кДж/моль ∆Н0сгорС2Н5ОН(ж) = -1366,9 кДж/моль |
| 44. | Вычислить тепловой эффект реакции (∆H0p): СН3СООН+НОС2Н5 = СН3СООС2Н5+Н2О, используя следующие данные: ∆Н0сгорСН3СООН(ж)= -874,58 кДж/моль ∆Н0сгорС2Н5ОН(ж)= -1370,68 кДж/моль ∆Н0сгорСН3СООС2Н5(ж)= -2246,39 кДж/моль |
| 45. | Вычислить энтальпию (∆Н) реакции полного окисления этилового спирта до уксусной кислоты, если энтальпии образования всех веществ, участвующих в реакции, равны: ∆Н0обр. С2Н5ОН (ж) = -277 кДж/моль; ∆Н0обр. СН3СООН (ж) = -487 кДж/моль; ∆Н0обр. Н2О (ж) = -285,9 кДж/моль; ∆Н0обр. О2 = 0. |
| 46. | Определить изменение изобарно-изотермического потенциала при стандартных условиях для реакции 2НСl (г) + Са (т) = СаСl2 (т) + Н2(г),если ∆Gоf для HCl (г) = + 94,9 кДж/моль, для CaCl2 (т) = + 749,5 кДж/моль. Протекает ли этот процесс самопроизвольно? |
| 47. | В каком направлении пойдет реакция С6Н12 = 3 С2Н4 при 1000 К, если при этой температуре ∆Gоf для С6Н12 = + 402,1 кДж/моль, С2Н4 = + 114,1 кДж/моль. |
| 48. | Вычислить ∆G0 процесса 2СН4(г)=С2Н2(г)+3Н2(г) и сделать вывод о возможности его самопроизвольного протекания, если ∆S0процесса=221,42 Дж/(моль·К); ∆Н0процесса = -376,45 кДж/моль; |
| 49. | Тепловой эффект реакции С(ТВ) + 1/2О2(Г) = СО(Г), протекающей при постоянном объеме и температуре 20°С, равен -108,9 кДж/моль. Определить тепловой эффект данной реакции при постоянном давлении при той же температуре. |
| 50. | Изменение стандартной свободной энергии Гиббса для реакции 2Н2(г)+СО(г) = СН3ОН(г)равно -25,21 кДж/моль. Рассчитайте величину константы равновесия. |
| 51. | Для молярной изохорной теплоёмкости этина С2Н2(г) известна следующая зависимость от температуры: 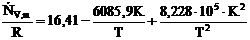 в интервале температур от 300 до 1000 К. Вычислите изменение энтропии этина при изохорном нагревании от 300 до 698 К. в интервале температур от 300 до 1000 К. Вычислите изменение энтропии этина при изохорном нагревании от 300 до 698 К.
|
| 52. | Вычислите изменение энтропии при выравнивании температур двух брусков титана с массами: масса одного 1,988 кг (начальная температура 20,0 °С), а масса другого 4,023 кг (начальная температура 30,0 °С) (ср = 524 Дж К–1 кг–1). |
| 53. | Одноатомный идеальный газ подвергается обратимому изменению состояния от 0 °С (точно) и р = 1,00 бар до –40,0 °С и р = 0,202 бар. Насколько изменяется его молярная энтропия? (Вспомните, в связи с этим, уравнение состояния идеального газа) |
| 54. | Увеличивается или уменьшается энтропия в следующих реакциях, и в какой из них изменение больше по абсолютной величине? а) Н2 (г) + О2 (г) ® Н2О2 (ж); б) 2Н2 (г) + О2 (г) ® 2Н2О (ж). |
| 55. | Тепловой эффект некоторой реакции ∆Н° = +50 кДж/моль и не зависит от температуры, при температуре 1250 К в системе установилось равновесие. Чему равно изменение энтропии в ходе этой реакции? |
| 56. | Рассчитать калорийность молочных сосисок массой 250г, если 100 г этой порции содержат 11,0 г белков; 1.6 г углеводов; 23,9 г жиров. Коэффициенты калорийности брать по нижней границе. |
| 57. | Рассчитать калорийность банки майонеза «Провансаль», если масса нетто составляет 200 г, а 100 г продукта содержит 2.8 г белков, 2.6 г углеводов, 67,0 г жиров. Коэффициенты калорийности брать по верхней границе. |
| 58. | В 100 г мяса свинины содержится 14,3 г белка, 33,3 г жиров. Рассчитайте калорийность 500 г мяса. Коэффициенты калорийности брать по нижней границе. |
| 59. | В 100 г сгущенного молока содержится белков 7,0 г, жиров 1,0 г, углеводов 71,8 г. Рассчитайте калорийность 180 г продукта. |
| 60. | Рассчитать калорийность пропорции жареного картофеля массой 300 г, если 100 г этого блюда содержат 2,8 г белков; 9,5 г жиров; 23,4 г углеводов. Коэффициенты калорийности брать по нижней границе. |
Тема 4. Химическая кинетика и равновесие. Катализ
Контрольные задания 61 – 70
Вопросы заданий:
1. Ответьте на вопросы (А).
2. Решите задачу (Б). Для всех обратимых процессов приведите выражения констант химического равновесия.
| № | (А)Вопрос |
| 61. | Понятие о скорости химической реакции, выражение ее для гомогенных и гетерогенных процессов. |
| 62. | Параметры химических систем и их влияние на скорость химических реакций. |
| 63. | Закон действующих масс. Константа скорости химической реакции. |
| 64. | Правило Вант-Гоффа. Температурный коэффициент. Активные молекулы, энергия активации. |
| 65. | Катализ, катализаторы. Гомогенный и гетерогенный катализ. |
| 66. | Особенности каталитических реакций и их значение. |
| 67. | Причина проявления энергетических эффектов в химических реакциях. Реакции экзо- и эндотермические, их условная запись. |
| 68. | Необратимые и обратимые реакции. Перечислить признаки необратимых реакций и показать на конкретных примерах. |
| 69. | Химическое равновесие, его количественная характеристика. |
| 70. | Смещение химического равновесия. Принцип Ле Шателье. Влияние концентрации, давления и температуры на смещение химического равновесия. |
| (Б)Задача | |
| 61. | Окисление углерода и оксида углерода(II) протекает по уравнениям: а)С(к)+O2(г) = СО2 (г); б)2СO(г)+O2(г) ↔2СО2(г). Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в три раза? |
| 62. | В гомогенной системе 2 NO + O2 ↔ 2NO2 равновесные концентрации веществ равны: [NO] = 0,20; [O2] = 0,30; [NO2] = 0,49 моль/л. Вычислить значение константы равновесия системы и исходные концентрации оксида азота(II) и кислорода. |
| 63. | Константа равновесия системы CО (г) + FeO (к) ↔ СО2 (г) + Fe (к) при некоторой температуре равна 0,5. Вычислить равновесные концентрации CО и СО2, если их исходные концентрации соответственно равны 0,05 и 0,01 моль/л. |
| 64. | Какие факторы следует изменить для увеличения выхода азота и водорода в системах: а) 3 N2O + 2 NH3 ↔ 4 N2 + 3 H2O DН 0 = – 878,64 кДж; б) CH4 + CO2 ↔ 2H2 + 2 CO DН 0 = + 266,5 кДж? |
| 65. | Как изменятся скорости прямой и обратной реакций при увеличении объема в два раза в системах: а) N2 (г) + 3 H2 (г) ↔ 2 NH3 (г); б) CS2 (ж) +3О2 (г) ↔ СO2 (г) + 2 SO2 (г)? В сторону какой реакции сместится равновесие? |
| 66. | В системе CO (г) + Cl2 (г) ↔ COCl2 (г) начальные концентрации CO и Cl2 соответственно равны 0,56 и 0,18 моль/л. Равновесная концентрация при 300 К оксида углерода(II) равна 0,4 моль/л. Вычислить значение константы равновесия при данной температуре. |
| 67. | Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 30 оС, если температурный коэффициент скорости данной реакции равен 2? |
| 68. | Начальные концентрации исходных веществ в реакции 2 SO2 + O2 = 2 SO3 были равны: оксида серы(IV) – 1,3 моль/л и кислорода – 1,2 моль/л. Вычислить концентрации этих веществ в тот момент, когда образовалось 0,4 моль/л оксида серы(VI). |
| 69. | При 330 К реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 3, рассчитайте, через какой промежуток времени закончится реакция при 300 К. |
| 70. | Начальные концентрации водорода и кислорода соответственно равны 0,6 и 0,4 моль/л. Как изменится скорость реакции образования воды, если концентрацию водорода увеличить до 0,8, а концентрацию кислорода до 1,2 моль/л? |
Тема 5. Электрохимия. Электродные потенциалы
Контрольные задания 71 – 80
| № | Вопросы звдвния |
| 71. | Составить схему гальванического элемента, образованного металлическими электродами, опущенными в растворы их солей, используя значения стандартных электродных потенциалов (см. приложение табл. 5 и 12). Какие химические реакции будут проходить у электрода этого элемента при его работе? Напишите их, а так же уравнения общей химической реакции, на основе которой работает этот элемент. Какой из металлов расходуется при работе элемента? |
| 72. | Указать, какие электроды являются катодом и анодом и рассчитать ЭДС гальванических элементов. Будет ли работать этот гальванический элемент? |
| 73. | Вычислить время, в течение которого должен пропускаться ток силой I через раствор исходного вещества, чтобы на катоде (аноде) выделилось вещество массой m (или объёмом V). |
| 74. | Два металла находятся в контакте. Какой металл будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (НС1)? Составить электродные процессы катодного и анодного процессов. Каков состав продуктов коррозии? |
| 75. | Одним из способов защиты металлических изделий от коррозии является покрытие другим металлом. Какой металл, по отношению к покрываемому, является анодом или катодом? Почему? Составить электронные уравнения анодного и катодного процессов коррозии изделия при нарушении покрытия при влажном воздухе. Какие продукты коррозии при этом образуются? |
| 76. | Удельная электропроводность 0,01 н раствора KNO3 равна 0,001182 Ом–1·см–1. Подвижность иона К+ равна 64,5 Ом–1·см2 и иона NO3– 61,6 Ом1–·см2. Рассчитать эквивалентную электропроводность и степень диссоциации раствора KNO3. |
| 77. | Рассчитать эквивалентную электропроводность 1 н раствора NaNO3, если его удельное сопротивление равно 12,42Ом–1·м–1. |
| 78. | Удельная электропроводность 0,1 н раствора AgNO3 равна 0,00943 Ом–1·см–1. Эквивалентная электропроводность этого раствора при бесконечном разбавлении равна 115,6 Ом–1·см2. Найти кажущуюся концентрацию Ag+ в растворе. |
| 79. | Удельная электропроводность 0,05 н раствора уксусной кислоты равна 0,000324 Ом–1·см–1. Определить эквивалентную электропроводность, степень электролитической диссоциации и константу диссоциации кислоты, если эквивалентная электропроводность ее раствора при бесконечном разбавлении равна 347,8 Ом–1·см2. |
| 80. | Рассчитать ЭДС медно-цинкового гальванического элемента, в котором концентрация ионов Сu 2 + равна 0,001 моль/л, а ионов Zn2+ 0,1 моль/л. При расчетах учтите стандартные значения ЭДС: εо(Zn 2+ /Zn 0)=– 0,74 В и εо(Cu 2 + /Cu 0) = + 0,34 В. |
Модуль 3. Общие свойства растворов
Тема 6. Растворы как многокомпонентные системы
Контрольные задания 81 – 90
Вопросы задания:
1. Составьте формулы продуктов реакций (А, Б) и напишите все уравнения в молекулярном, полном и сокращенном ионном виде.
2. Напишите уравнения реакций гидролиза указанных солей (В) в ионной и молекулярной форме. Отметьте реакцию среды раствора соли, значение рН и окраску индикаторов.
3. Укажите условия усиления и подавления гидролиза перечисленных солей. Для солей, выделенных курсивом, вычислить значения констант гидролиза.
| № | Электролитическая диссоциация | Гидролиз солей | |
| (А) | (Б) | (В) | |
| 81. | KOH + FeCl3 | BaCO3 + HNO3 | Li2CO3, Fe(NO3)2 |
| 82. | Pb(OH)2 + NaOH | AgNO3 + KCl | K2SiO3, Cr2(SO4)3 |
| 83. | Sn(OH)2 + HNO3 | CaCO3 + HCl | Na2SO3, CoCl2 |
| 84. | Fe(OH)3 + H2SO4 | BaCl2 + K2SO3 | K3PO4, MgSO4 |
| 85. | Fe(OH)2 + HCl | NiCl2 + K2S | Li2S, CdCl2 |
| 86. | KOH + H2SO4 | CaCl2 + K3PO4 | NaCN, MgSO4 |
| 87. | Co(OH)2 + HNO3 | Na2SiO3 + HCl | K3BO3, Ni(NO3)2 |
| 88. | Сr(OH)3 + HNO3 | K2S + AgNO3 | NaNO2, BiCl3 |
| 89. | Sn(OH)2 + NaOH | K2SiO3 + Ba(NO3)2 | K2CO3, CoSO4 |
| 90. | KOH + CrCl3 | Mn(NO3)2 + Na2SО3 | NaZ, AICl3 |
Контрольные задания 91 - 110
Вопросы заданий:
1. На основании приведённых данных в задании (А) рассчитайте массовую долю растворённого вещества, его молярную концентрацию и молярную концентрацию эквивалента вещества.
2. Решение задач (Б)
| № | (А) | |||
| Формула вещества | Масса вещества, г | Масса воды, г | Плотность раствора, г/мл | |
| 91. | Al2(SO 4) 3 | 32 | 538 | 1,0360 |
| 92. | Ва(ОН) 2 | 16 | 884 | 1,0095 |
| 93. | Н 2SO 4 | 20 | 597 | 1,0200 |
| 94. | Na 2CO 3 | 23 | 337 | 1,0072 |
| 95. | Н 3РО 4 | 47 | 163 | 1,1100 |
| 96. | МgCl 2 | 58 | 622 | 1,0220 |
| 97. | Сu(NO 3) 2 | 65 | 991 | 1,0060 |
| 98. | FeCl 3 | 24 | 446 | 1,0052 |
| 99. | Pb(CH 3COO)2 | 15 | 230 | 1,0003 |
| 100. | Na 3PO 4 | 40 | 700 | 1,0046 |
| (Б) | ||||
| 101. | Массовая доля нерастворимых примесей в поваренной соли составляет 0,0835. Определите массу примесей и чистой соли в её партии массой 400 кг. | |||
| 102. | При растворении 5,4550 г анализируемого образца, содержащего железо, получено 250 мл раствора, на титрование 25,00 мл которого затрачено 25,00 мл 0,0186 н раствора KMnO4. Рассчитайте Т(КМnO4/Fe), массу и массовую долю железа в образце. | |||
| 103. | Определите объём раствора КОН с массовой долей 0,3 и плотностью 1,29 г/мл, если на его титрование затрачено 15,00 мл 0,2500 н раствора HСl. | |||
| 104. | 0,6300 г образца, содержащего медь, растворили и получили раствор, на титрование которого методом иодометрии затрачено 15,20 мл раствора тиосульфата натрия с титром по меди 0,0065 г/мл. Вычислите массу и массовую долю меди в образце. | |||
| 105. | В мерной колбе объёмом 100 мл приготовлен раствор щавелевой кислоты, концентрация которого составляет 0,0500 моль/л. На титрование 10 мл этого раствора затрачено 9,10 мл раствора KMnO4. Рассчитайте молярную концентрацию эквивалентов, Т(KMnO4) и Т(KMnO4/ Н2SO4). | |||
| 106. | Навеску технического хлорида натрия массой 2,4080 г растворили в мерной колбе объёмом 500 мл. На титрование 25,00 мл полученного раствора затратили 20,35 мл 0,1 н раствора нитрата серебра. Рассчитайте массу и массовую долю хлорида натрия в образце | |||
| 10.7 | На титрование раствора, полученного растворением 0,1420 г образца, содержащего железо, затрачено 24,85 мл 0,1005 н раствора KMnO4. Рассчитайте массу и массовую долю железа в образце. | |||
| 108. | Рассчитайте массовую долю NaOH в навеске вещества массой 1,0122 г, если на ее титрование после растворения необходимо 25,00 мл серной кислоты с Т (Н2SO4/NaOH) = 0,0170 г/мл. | |||
| 109. | Растворением 0,2842 г образца, содержащего хлорид магния, получено 250 мл раствора, на титрование 10,00 мл которого израсходовано 5,7 мл 0,0200 н раствора трилона-Б. Вычислите массу и массовую долю хлорида магния в образце. | |||
| 110. | Растворением в азотной кислоте серебряного сплава массой 0,1900 г приготовлен раствор, на титрование которого израсходовано 21,12 мл 0,0500 н раствора NaCl. Вычислите массу и массовую долю серебра в сплаве. | |||
Тема 7. Коллоидные системы. Получение и свойства коллоидных систем
Дата добавления: 2018-08-06; просмотров: 258; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
