Способы выражения концентрации растворов
Растворы – это однородные (гомогенные) системы, состоящие из двух или более компонентов (составных частей), относительные количества которых могутизменяться в широких пределах. Компонентами раствора являются растворенные вещества и растворитель. Растворитель – это компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода).
Важной характеристикой любого раствора является его состав, который определяется количеством растворенного вещества и растворителя. Отношение количества или массы вещества, содержащегося в системе, к объему или массеэтой системы называется концентрацией. Известно несколько способов выражения концентрации растворов.
Молярная концентрация вещества В,илимолярность(сВ или М) – отношение количестварастворенного вещества к объему раствора:
cB nB mB , моль/л, (1)
V MB V
где n B – количество вещества В; m B– масса вещества г; МВ– молярная масса вещества, г/моль; V – объем раствора, л.
Молярная концентрация эквивалентов вещества В,или нормальность(сэк(В) или н.) – отношение количества эквивалентов растворенного веществак объемураствора:
сэк В nэк В mB , моль/л, (2)
|
|
|
V Mэк BV
где nэк(В) – количество вещества эквивалентов; mB – масса вещества, г;
Мэк(В) – молярная масса эквивалентов вещества, г/моль; V – объем раствора, л.
Моляльная концентрация вещества В,или моляльность(сm(B)) - отношение количестварастворенного вещества к массе растворителя:
сm B nB mB 1000 , моль/кг, (3)
mS MB mS
где n В – количество растворенного вещества В; m B – масса раство-
ренного вещества,г; m S – масса растворителя, г; М В - молярная масса растворенного вещества, г/моль.
Массовая доля вещества В(ω) – отношение массырастворенного вещества к массе раствора. Массовая доля ─ безразмерная величина, ее выражают в долях единицы или процентах:
ωВ mB 100%, (4)
m
где m B – масса растворенного вещества; г; m – масса раствора, г.
Если выражать массу раствора через его плотность(ρ) и объем(V),
|
|
|
то ωB mB 100% (5)
ρV
Молярная (мольная) доля вещества В(хВ) ─ отношение количества растворенного вещества (или растворителя)к сумме количеств всех веществ, содержащихся в растворе: хB nB , (6)
nB nS
где х B – молярная доля растворенного вещества; n B – количество растворенного вещества; n S – количество растворителя; xS nS , (7)
nB nS
где х S – молярная доля растворителя; n B и n S – количество растворенного вещества и растворителя.
Титр раствора вещества В(ТВ) показывает число граммов растворенноговещества, содержащегося в 1мл (см3) раствора. Титр рассчитывается по формулам:
ТВ МэкВсэкВ, г/мл, (8)
1000
где Мэк (В) – молярная масса эквивалентов вещества; сэк(В) – молярная концентрация эквивалентов;
ТВ ωВ ρ , г/мл, (9)
|
|
|
100
где ωВ – массовая доля растворенного вещества; ρ – плотность раствора.
Примеры решения задач
Пример 8.1. Водный раствор содержит 354 гH3PO4 в 1 л. Плотность раствора ρ = 1,18 г/см3. Вычислить: а) массовую долю (%)H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность; д) титр; е) молярные доли H3PO4 и Н2О.
Решение.а) для расчета массовой доли воспользуемся формулой (5):
ωн3ро4 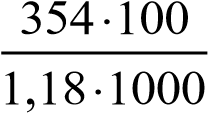 30 %
30 %
б) молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию
раствора находим из соотношения (1):
сН3РО4 = 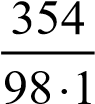 3,61 моль/л;
3,61 моль/л;
в) молярная масса эквивалентов H3PO4 равна 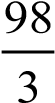 32,7 г/моль. Молярную концентрацию эквивалентов рассчитываем по формуле (2): сэк(Н3РО4) =
32,7 г/моль. Молярную концентрацию эквивалентов рассчитываем по формуле (2): сэк(Н3РО4) = 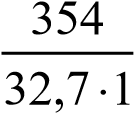 10,83 моль/л;
10,83 моль/л;
г) для определения моляльности по формуле (3) необходимо рассчи-
тать массу растворителя в растворе. Масса раствора составляет 1,18 ∙ 1000 = 1180 г; масса растворителя в растворе mS = 1180 – 354 = 826 г. Моляльная концентрация раствора равна:
cm (H3PO4 ) 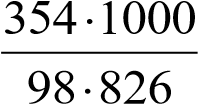 4,37 моль/кг;
4,37 моль/кг;
д) титр раствора можно рассчитать по пропорции:
1000 мл раствора содержит 354 г H3PO4
1 мл « « х г «
х =  0,354 г/мл,
0,354 г/мл,
а также по формулам (8) и (9):
|
|
|
Н3РО4 32,710,83 0,354 г/мл или
Т
1000
Н3РО4 301,18 0,354 г/мл;
Т
100
е) в 1 л раствора содержится 3,61 моль H3PO4 (см. п. б); масса растворителя в растворе 826 г, что составляет 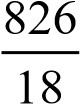 45,9 моль.
45,9 моль.
Молярные доли H3PO4 и Н2О рассчитываем по формулам (6) и (7):
хН3РО4 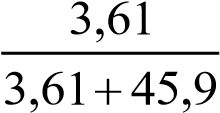 0,073; хН2О
0,073; хН2О 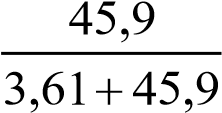 0,927.
0,927.
Пример 8.2. Сколько миллилитров 50 %-ного раствора HNO3, плотность которого 1,32 г/см3, требуется для приготовления 5 л 2 %-ного раствора, плотность которого 1,01 г/см3?
Решение. При решении задачи пользуемся формулой (5). Сначала находим массу азотной кислоты в 5 л 2%-ного раствора: mHNO3 1 ,0150002 101г.
100
Затем определяем объем 50 %-ного раствора, содержащего 101г HNO3:
V 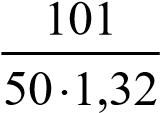 1,53 мл.
1,53 мл.
Таким образом, для приготовления 5 л 2 %-ного раствора HNO3 требуется 1,53 мл50 %-ного раствора HNO3.
Пример 8.3. На нейтрализацию 50млраствора кислоты израсходовано 25 мл0,5 н. раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
VA ∙ cэк(А) = VB ∙ сэк(B);
50 ∙ сэк(кислоты) = 25 ∙ 0,5, отсюда сэк(кислоты) = 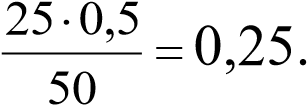
Следовательно, для реакции был использован 0,25 н. раствор кислоты.
Пример8.4 Сколько граммов 15 %-ного раствора NaCl надо прибавить к 1000 г 80 %-ного раствора, чтобы получить 30 %-ный раствор?
Решение. Задачи такого типа решаются по правилу смешения, согласно которому массы исходных растворов, необходимые для приготовления смеси, обратно пропорциональны разности между концентрациями заданного и менее концентрированного растворов и более концентрированного и заданного растворов.
Обозначив искомую массу 15 %-ного раствора через х, концентрацию 15 %-ного раствора (менее концентрированного) через С1, концентрацию 80 %-ного раствора (более концетрированного) через С2 и концентрацию 30 %-ного раствора (заданного) через С3, находим:
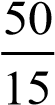
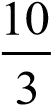 х С2 С3 8030 .
х С2 С3 8030 .
1000 С3 С1 3015
Отсюда
х = 1000 10 3333 г.
3
Решение может быть также оформлено посредством диагональной схемы или «правила креста»: точкой пересечения двух отрезков прямой является заданная концентрация. У концов обоих отрезков расположены по одну сторону от точки пересечения исходные концентрации, по другую – разности концентраций, для чего по диагонали из большего значения концентрации вычитают меньшую. Затем составляют отношение масс исходных растворов и вычисляют. Диагональная схема данной задачи имеет вид:
m1 = x г 15 50 30 m1 x 8030 50 = 10 .
m2 1000 3015 15 3
m2 = 1000 г 80 15
Пример8.5. Какой объем раствора гидроксида калия, в котором массовая доля КОН 5% (ρ =1,04 г/см3), требуется для реакции с 20 мл10%ного раствора, FeCl3, плотность которого 1,087 г/см3? Решение. Находим массу 20 мл FeCl3:
mFeCl3 10 1,08720 2,174г.
100
По уравнению реакции FeCl3 + 3KOH = Fe(OH)3 + 3KCl вычисляем массу КОН, требуемую для реакции с 2,174г FeCl3:
162,5 г FeCl3 ─ 168 г КОН 2,174 г FeCl3 ─ m гКОН
mKOH 2,174168 2,254 г.
162,5
Находим требуемый объем раствора КОН:
VKOH 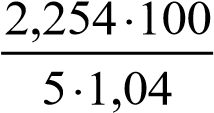 43,3 мл.
43,3 мл.
Итак, для реакции с 20 мл 10%-ного раствора FeCl3 требуется
43,3 мл КОН.
Дата добавления: 2018-06-27; просмотров: 370; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
