Обработка поверхностей металлов
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ
Государственное бюджетное
Общеобразовательное учреждение города Москвы
«Гимназия №1516»
107589. г.Москва, ул. Хабаровская. д. 4А; тел(факс) 8-495-460-4366;
http://www.gogi1516.ru/ ; E-Mail: 1516@edu.mos.ru
ИНН 7718792108 КПП 771801001 ОГРН 1107746022560
Научныйпроектпофизике
Тема: «Применение электролиза»
Автор: Идрисов Султан
Ученик 10 «Б» класса
Москва
Г.
Оглавление:
Получение металлов. 4
Очистка металлов. 5
Обработка поверхностей металлов. 6
Получение органических веществ. 9
Электролиз и обессоливание воды.. 11
Электрофорез. 14
Применение в очистке сточных вод.. 15
Электрокоагуляция. 16
Электрофлотация. 17
Электроэкстракция. 19
Список источников и литературы: 23
Получение неорганических веществ
ХОД электроэнергии при промышленном электролитическом получении водорода и кислорода. Реакция образования кислорода играет важную роль практически во всех анодных процессах при электролизе водных растворов и в первую очередь в реакциях электроокисления неорганических и органических веществ. Однако механизм анодного выделения кислорода до сих пор не совсем ясен
Особенностью и преимуществом электрохимических методов производства перед химическими является сравнительная простота и дешевизна получения ряда продуктов, таких как гидроксид натрия и хлор, щелочные и щелочноземельные металлы, алюминий, пероксидные соединения, различные неорганические вещества высокой степени чистоты, обычно недостигаемой при химических методах их получения. Благодаря возможностям электрохимических технологий сформировалась целая отрасль современной индустрии — электрохимическая промышленность, к наиболее важным задачам которой относится обеспечение народного хозяйства ценными неорганическими продуктами (гидроксидами щелочных металлов, дезинфицирующими растворами, неорганическими окислителями), высокочистыми металлами, химическими источниками тока
|
|
|
В 1882 г. А.П. Лидовым и В.А. Тихомировым был разработан электрохимический способ получения гипохлорита натрия NaOCl. Процесс проводился в бездиафрагменном электролизере в растворе хлорида натрия NaCl. На аноде образовывался как гипохлорит-ион ClO—, так и хлор. При взаимодействии хлора с гидроксид-ионами ОН—, накапливающимися у катода, образуется гипохлорит-ион. При более высоких напряжениях гипохлорит-ионы на оксидно-рутиниево-титановые анодах (ОРТА) окисляются до хлорат-ионов.
Электрохимический способ получения хлоратов натрия и калия был разработан в 1886 г. При электролизе растворов хлоратов на аноде (платинированном титане или диоксиде свинца PbO2) образуются хлорная (НСlO4) и хлорноватая (НСlO3) кислоты. Из хлорной кислоты можно получить ее соли, называемые перхлоратами.
|
|
|
В 1958 г. под руководством Р.И. Агладзе (СССР) был разработан простой способ получения перманганата калия путем анодного окисления марганца, при этом на катоде идет выделение водорода.
К одному из важнейших электрохимичеких процессов следует отнести электрохимическое получение диоксида марганца MnO2, применяемого в качестве катодного материала источников тока, катализатора, абсорбента, окислителя, поглотителя и т.д. В СССР первая установка по получению MnO2 была пущена к 1934 г. в Ленинграде. Процесс заключался в анодном окислении ионов Mn+ с выделением водорода на катоде. Первоначально в качестве анода служил графит, позднее — титан и сплав титана с марганцем.
Получение металлов
Электрометаллургия – восстановление металлов в процессе электролиза растворов и расплавов солей.
Например, металлический натрий получают электролизом расплава хлорида натрия:
K (-) Na+ + 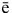 = Na,
= Na,
A (+) 2Cl- -2 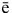 = Cl2,
= Cl2,
2NaCl  2Na + Cl2;
2Na + Cl2;
Медь можно получить электролизом раствора сульфата меди:
|
|
|
K (-) Cu2+ + 2 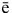 = Cu,
= Cu,
A(+) 2H2O – 4 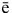 = O2 + 4H+,
= O2 + 4H+,
2CuSO4 + 2H2O  2Cu + O2 + 2H2SO4;
2Cu + O2 + 2H2SO4;
Электролиз водных растворов солей металлов применяется как для получения покрытий на металлах, так и для получения самих металлов. На структуру осаждающегося металла большое влияние оказывает состав электролита. Как правило, при электролизе растворов комплексных солей металлов металлы получаются в мелкокристаллическом виде, в виде плотных осадков, пригодных в качестве защитных и декоративных покрытий. При электролизе простых солей металлы получаются в виде губки, чешуек или дендритов, слабо сцепленных с катодом. На структуру получающегося металла большое влияние оказывает плотность тока.
В значительных количествах этим методом получают порошкообразное железо, медь, кобальт и некоторые другие металлы, используемые в порошковой металлургии.
Для получения железа применяют ванну, содержащую хлориды двух- и трехвалентного железа, и электролиз ведут при катодной плотности тока в 10—20 а/дмг при температуре 90°. В качестве катода используют листы хромированного железа, в качестве анода — чистое железо. После электролиза катоды вынимают из ванн, железо соскребывают, сушат и размалывают.
|
|
|
Электролиз расплавов
Помимо электролиза водных растворов, в промышленности применяется электролиз расплавов, главным образом хлоридов и щелочей. Этим методом получают магний (электролизом карналлита KMgCl3), натрий (электролизом едкого натра или хлористого натрия).
В качестве электролита при получении металлов этим методом используют щелочи и галогениды. Если удельный вес получаемого металла меньше удельного веса электролита (для щелочных металлов, магния), то металл всплывает на поверхность электролита, где он защищается от окисления железным колпаком (рис. 69). В другом случае металл защищается от окисления расплавленным электролитом (см. получение алюминия).
Этим методом получают щелочные металлы, бериллий, магний, кальций, алюминий, титан и некоторые другие. В качестве электролитов соответственно применяют: 1) щелочи; 2) хлорид бериллия в смеси с хлористым натрием; 3) карналлит KMgG8; 4) хлористый кальций; 5) криолит Na3AIFe, в котором растворена окись алюминия; 6) фтортанталат калия K2TaF7.
Очистка металлов
Электролитическое рафинирование неочищенной меди. Неочищенная медь окисляется на аноде, а рафинированная медь осаждается на катоде. Медь здесь растворяется в виде ионов Cu +, а примеси собираются под анодом, образуя анодный шлак . Стоимость редких металлов, извлекаемых из анодного шлака, таких, как золото, серебро и платина, часто компенсирует расходы на проведение процесса рафинирования.
Растворение анодов должно быть избирательным, т. е. один из компонентов материала анода должен растворяться количественно (часто в виде определенных ионов), а другие его составляющие не должны растворяться совсем.
Чаще всего для очистки ржавчины на металлах используют электролиз. Для этого в раствор кислоты , (соляной, серной) добавляют ингибитор к примеру:уротропин, тогда ржавчина растворится, металл практически останется не тронутым. Можно и другим раствором проводить электролиз например: раствором кальцинированной соды с водой (Na2CO3+H2O)
При катодной очистке выделяется водород, который поглощается металлом и появляется хрупкость у металла, чтобы предотвратить ее, после катодной обработки металл надо прогреть (250-300 С, а может и больше, зависит от сплава).
Обработка поверхностей металлов
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
Электрохимическая обработкаизделий для придания им требуемой формы получила название Анодной обработки. Этот способ обработки металлов во многих случаях имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации и металлы, которые механически или вообще не могут быть обработаны, или обрабатываются с большим трудом (например, очень твердые металлы и сплавы). Кроме того, инструмент (катод) при этом не изнашивается, а обработка не влечет изменения структуры металла. К недостаткам ЭХОМ относятся большой расход энергии и малая производительность, поэтому этот метод не применяется для обработки обычных металлов и сплавов и изделий простой конфигурации. Как и при обычном электролизе с растворимыми анодами, при ЭХОМ происходит анодное растворение металла М — пе~ ->* М"+. На катоде, который при электрохимической обработке называют инструментом, обычно выделяется водород 2Н + 2е Нз.
Всего на данный момент известно 3 электрохимических метода обработки металлов: анодный, катодный и смешанный. Итак, следует разобраться в них более подробно.
Анодная обработка заключается в наращивании оксидной пленки, толщина которой не должна превышать 50 микрон. Существует несколько видов подобного процесса:
• Травление – удаление какой-либо части поверхностного слоя заготовки. Чаще всего применяется перед покраской или сборкой. Используется и в качестве подготовки к сварке под давлением.
• Полирование – травление шероховатостей болванки вплоть до зеркального состояния, а также дезактивация радиоактивного заражения изделий. Отдельного упоминания заслуживает возможность снятия слоя до ста микрон.
• Размерная обработка – окисление верхних слоев изделия с дальнейшим удалением оксидов недостаточной плотности.
Катодная обработка, или же гальванотехника, состоит в нанесении металлического покрытия на заготовку. Применяется заметно реже анодирования, но тоже имеет несколько видов:
• Гальваностегия – нанесение на внешний слой заготовки тонких металлических покрытий толщиной до нескольких десятков микрометров.
• Гальванопластика – основное отличие от гальваностегии в том, что толщина покрытия достигает нескольких миллиметров и отличается составом от материала болванки.
Смешанная обработка – состоит в попеременном использовании двух перечисленных выше методов, что позволяет пользоваться преимуществами обоих из них.
Особенностью ЭХОМ по сравнению с другими методами электролиза является высокая скорость растворения металлов. Плотности тока при электрохимической обработке металлов в сотни и тысячи раз выше плотностей тока других электрохимических процессов. Для обеспечения высоких скоростей процесса (высоких плотностей тока) при относительно невысоких напряжениях необходимо снизить омическое падение напряжения и поляризацию электродов. Омическое падение напряжения достигается снижением зазора между электродами (до 0,1 мм) и использованием раствора электролита с высокой электрическойпроводимостью. Более сложной, но в то же время очень важной задачей является снижение поляризации
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатирование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Для предотвращения пассивирования металла процесс необходимо вести в активной области, т. е. при малой поляризации. Следовательно, для предотвращения пассивности необходимо снижать анодную поляризацию. Существенную роль при электрохимической обработке металлов играет концентрационная поляризация, так как при высоких скоростях растворения металла и малом расстоянии между электродами может происходить быстрое изменение концентрации продуктов реакции в межэлектродном пространстве.
Источниками постоянного тока при электрохимической обработке металлов служат электродвигатели — генераторы низкого напряжения, рассчитанные на большую силу тока, или полупроводниковые многоамперные выпрямители, состоящие из трансформатора и вентиля, пропускающего электрический ток только в одном направлении электронные, селеновые, германиевые, кремниевые и др. В практике электролитических цехов покрытий применяют индивидуальное питание отдельных ванн и питание одновременно нескольких ванн, включенных параллельно.
Электрохимическое полирование представляет собой анодную обработку металла для создания ровной и блестящей поверхности. Изделие, имеющее микро- и макронеровности, является анодом электролизера. Катодом служит металл, химически не растворимый в растворе электролита. В качестве растворов электролитов используют растворы фосфорной, хромовой, серной, уксусной, плавиковой кислот и др. В процессе электрополировки происходит анодное растворение металла на макро- и микровыступах, в результате чего поверхность становится гладкой и блестящей. На катоде выделяется водород. Механизм электрополировки окончательно не выяснен. Эффект электрополирования обычно связывается с действием вязкой пленки, образующейся в прианодном слое, затрудняющем растворение металла в углублениях по сравнению с растворением на выступах, а также поочередным пассивированием и активированием металла.
По сравнению с механической полировкой электрополировка менее трудоемка, лучше поддается автоматизации, позволяет обрабатывать металлы, которые трудно полировать механически. Кроме того, при электрополировке не происходит искажения структуры металла. Электрополировка широко используется для изучения структуры металлов и сплавов, а также в промышленности для обработки нержавеющей и углеродистой сталей, никеля, алюминия, меди и ее сплавов.
Анодное оксидирование (анодирование) широко применяется для обработки алюминия. Алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, хромовой, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий сраствором электролита, например свинец. На катоде выделяется водород, на аноде происходит образование оксида алюминия Al2О3. Суммарный процесс на аноде можно представить следующим уравнением:
2Аl + ЗН20 - 6е- = Аl2O3 + 6Н+
Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образованием оксида происходит его частичное растворение в кислоте: Аl2O3 + 6Н+ = 2Аlз+ + ЗН20
Дата добавления: 2018-06-01; просмотров: 670; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
