Основные направления фрагментации важнейших классов органических соединений
Практические основы интерпретации масс-спектров и некоторые масс-спектрометрические правила
Для успешной интерпретации масс-спектра необходимо располагать следующими данными: метод синтеза и выделения анализируемого соединения, природа исходных реагентов и растворителей, наличие примесей, параметры съемки масс-спектра и т.д.
Масс-спектр может состоять из нескольких типов ионов:
1. Молекулярный ион.
2. Перегруппировочные ионы.
3. Фрагментные ионы.
4. Многозарядные ионы.
5. Метастабильные ионы.
Молекулярный ион.Основную работу с масс-спектром начинают с установления пика молекулярного иона. Анализируя форму и относительную интенсивность пика молекулярного иона, можно получить очень важную информацию.
Масса M+• – это молекулярная масса анализируемого соединения. Соотношение изотопных пиков позволяет установить примерный элементный состав, а измерение точной массы M+• с помощью масс-спектрометрии высокого разрешения – точный элементный состав соединения. Относительная интенсивность пика M+• позволяет сделать определенные предположения о его структуре и принадлежности анализируемого соединения к тому или иному классу.
Молекулярный ион должен удовлетворять следующим условиям:
1. Иметь самую большую массу в спектре.
2. Быть нечетноэлектронным.
3. Быть способным образовать важнейшие ионы с большой массой за счет выброса реальных нейтральных частиц.
|
|
|
4. Включать все элементы, наличие которых в образце можно увидеть по фрагментным ионам.
Количество электронов в ионе можно проверить, рассчитав степень его ненасыщенности:
R = x – 1/2y + 1/2z + 1,
где R - степень ненасыщенности (число кратных связей и циклов ионе);
х, z – индексы в брутто-формуле иона CxHyNzOn.
Если в состав входят другие элементы, индексы х, у, n, z будут суммами атомов соответствующих валентностей (для С и Si 4–х, N и Р 3–z, О и S 2–n, Н и Hal 1–у).
Если R – целое число, ион нечетноэлектронный и, следовательно, может быть молекулярным; если R – дробь, ион четноэлектронный и молекулярным быть не может.
Третье необходимое условие позволяет проверить правильность выбора M+• на основании анализа первичных фрагментных ионов. Обычно M+• легко отщепляет молекулы СО, СО2, Н2О, С2Н4, HHal; радикалы Alk•, Н•, Наl•, ОН• и т.д. Потери из M+• от 5 до 14 или от 21 до 25 а.е.м., приводящие к возникновению интенсивных пиков ионов, крайне маловероятны. Если в спектре такие пики все же присутствуют, пик M+•, по-видимому, выбран неверно; или образце имеются примеси. Например, если в масс-спектре чистого соединения самый тяжелый ион имеет массу 120, следующий за ним – 112, ион 120 – не молекулярный, а фрагментный, т.е. в данном случае M+• нестабилен и не регистрируется в спектре. Поскольку большинство химических элементов имеет несколько стабильных изотопов, элементный состав ионов можно с определенной степенью надежности установить по обычным масс-спектрам низкого разрешения.
|
|
|
Молекулярному иону сопутствуют так называемые «изотопные пики» – пики ионов, имеющих массу большую, чем молекулярный ион. Изотопные пики, как правило (исключение – бромсодержащие вещества), существенно менее интенсивны, чем молекулярный ион, и при этом их интенсивность подчиняется ряду закономерностей, что позволяет определить элементный состав образца или иона даже по масс-спектру низкого разрешения. Для этого производят анализ группы линий молекулярного иона: M+•, (M+1)+•, (M+2)+• и т.д., сравнивая их интенсивности. Интенсивность изотопных спектральных линий, соответствующих определенному иону, зависит от элементного состава данного иона.
Определение элементного состава соединения следует начинать с пика М+2: если интенсивность пика М+2 составляет менее 3% от интенсивности пика М, соединение не содержит атомов хлора, брома, серы и кремния.
Кроме того, хлор, бром, сера и кремний легко детектируются методом масс-спектрометрии благодаря характерной для каждого элемента мультиплетности сигнала (рис. 1), зависящей от природной распространенности изотопов соответствующих элементов, т.е. можно определенно сказать, какое количество атомов указанных элементов находится в соединении.
|
|
|

Рис. 1. Графический вид кластеров ионов с разным содержанием атомов хлора и брома
Несмотря на относительно малую распространенность природного изотопа 18О (примерно 0,2% от основного изотопа 16О), вполне правомерно делать определенные предположения о числе атомов кислорода в молекуле: если интенсивность пика иона М+2 в спектре образца с небольшим числом атомов углерода в молекуле больше 0,5% от интенсивности M+•, можно предположить, что в состав соединения входит один или более ато-мов кислорода. Другими словами, каждый атом кислорода в молекуле повышает интенсивность сигнала М+2 иона на 0,2% от интенсивности сигнала M+•.
В зависимости от источника анализируемого образца содержание изотопа 13С может колебаться в диапазоне 1,08–1,12% от 12С. При интерпретации масс-спектров обычно используется величина отношения 13С к 12С 1,1%. Так, наличие одного атома углерода в молекуле метана приводит появлению наряду с пиком M+• с m/z 16 пика иона с m/z 17 и интенсивностью 1,1% от M+• за счет молекул 13СН4. Интенсивность пиков ионов М+1, М+2, М+3 и т.д. для органических соединений прямо пропорциональна содержанию атомов углерода в молекуле анализируемого вещества (табл. 1): увеличение числа атомов углерода в молекуле приводит увеличению интенсивности пиков ионов М+1 до величины 1,1n%, где n – число атомов углерода молекуле.
|
|
|
Для большинства элементов, входящих в состав органических соединений, имеется соответствие между валентностью и массой наиболее распространенного изотопа: либо оба числа четные (С, О, S, Si, Ge, Pb и др.), либо – нечетные (H, F, Cl, Br, I, As, Sb и др.). Важнейшим исключением является азот, который имеет четную массу и нечетную валентность. Так в масс-спектрометрии появилось азотное правило: если соединение содержит четное число атомов азота или азота в составе нет, его молекулярная масса четная; если число атомов азота нечетное, молекулярная масса тоже нечетная. Правило применимо не только к молекуле и молекулярному иону, но и к фрагментным ионам. В этом случае оно формулируется следующим образом: нечетноэлектронный ион имеет четную массу, если содержит четное число атомов азота; четноэлектронный ион имеет четную массу, если содержит нечетное число атомов азота.
Наличие и количество атомов азота и других элементов в структуре органического соединения также можно идентифицировать по их вкладу в интенсивности пиков ионов М+1 и М+2 (табл. 2).
Таблица 1 - Вклад изотопов углерода в интенсивности пиков изотопных ионов. Интенсивность основного пика (М) принята 100%
| Число атомов углерода в молекуле | (М+1) | (М+2) | (М+3) | (М+4) |
| 1 | 1,1 | 0 | 0 | 0 |
| 2 | 2,2 | 0,01 | 0 | 0 |
| 3 | 3,3 | 0,03 | <0,01 | 0 |
| 4 | 4,4 | 0,07 | <0,01 | <0,01 |
| 5 | 5,5 | 0,12 | <0,01 | <0,01 |
| 6 | 6,6 | 0,18 | <0,01 | <0,01 |
| 7 | 7,7 | 0,25 | <0,01 | <0,01 |
| 8 | 8,8 | 0,34 | <0,01 | <0,01 |
| 9 | 9,9 | 0,44 | 0,01 | <0,01 |
| 10 | 11,0 | 0,54 | 0,02 | <0,01 |
| 11 | 12,1 | 0,67 | 0,02 | <0,01 |
| 12 | 13,2 | 0,80 | 0,03 | <0,01 |
| 13 | 14,3 | 0,94 | 0,04 | <0,01 |
| 14 | 15,4 | 1,10 | 0,05 | <0,01 |
| 15 | 16,5 | 1,27 | 0,06 | <0,01 |
| 16 | 17,6 | 1,45 | 0,07 | <0,01 |
| 17 | 18,7 | 1,65 | 0,09 | <0,01 |
| 18 | 19,8 | 1,86 | 0,11 | <0,01 |
| 19 | 20,9 | 2,07 | 0,13 | <0,01 |
| 20 | 22,0 | 2,30 | 0,15 | <0,01 |
Таблица 2 - Вклад изотопов некоторых элементов в интенсивности пиков (М+1) и (М+2)
| Элемент | Вклад в (М+1), % | Вклад в (М+2), % |
| N | 0,37 | – |
| O | 0,04 | 0,2 |
| F | – | – |
| Si | 5,1 | 3,4 |
| P | – | – |
| S | 0,8 | 4,4 |
| Cl | – | 32,5 |
| Br | – | 98,0 |
В силу того, что зачастую при ионизации молекулам передается большое количество энергии (до 70 эВ), а прочность химических связей составляет порядка 10–20 эВ, молекулярный ион может претерпевать фрагментацию – разрушение через разрыв связей по разным направлениям, обусловленным исходным строением молекулы. По этой причине в масс-спектрах некоторых соединений молекулярный ион отсутствует, как, например, в масс-спектре CCl4, в котором имеются только фрагментные ионы CCl3+ (117), CCl2+ (82), CCl+ (47), Cl+ (35) и C+ (12).
Фрагментные ионы можно разделить на перегруппировочные и осколочные, однако при интерпретации масс-спектра пользуются также другой классификацией. Все важнейшие фрагментные ионы можно разделить на три вида:
1. Наиболее тяжелые ионы, образующиеся из M+• в результате выброса простейших частиц, т.е. без существенной перестройки структуры исходной молекулы.
2. Ионы, характеризующиеся наиболее интенсивными пиками в спектре.
3. Характерные серии ионов, различающихся на гомологическую разность, т.е. на 14 а.е.м.
Эффективность процесса фрагментации определяется стабильностью не только дочернего иона, но и отщепляющейся нейтральной частицы. При оценке стабильности можно использовать обычные критерии, известные из курса органической химии. Третичный алкильный карбокатионустойчивее вторичного, вторичный – первичного. Для карбанионов этого типа порядок стабильности обратный. Бензильный и аллильный ионы устойчивы благодаря резонансной стабилизации, причем для бензильного катиона помимо четырех резонансных форм существует возможность энергетически выгодной в газовой фазе трансформации в катион тропилия, который имеет уже семь резонансных форм (рис. 2).

Рис. 2. Резонансная стабилизация бензильного катиона
Распад может осуществляться по определенному направлению благодаря удобной делокализации электрона в нейтральном продукте фрагментации. В этом случае вновь «работают» классические правила органической химии. Делокализация электрона вследствие эффекта резонанса увеличивает стабильность аллильного или бензильного радикалов, участие связей α-СН приводит к повышенной стабильности третичных алкильных радикалов и т.д.
Зачастую ионы распадаются с выбросом небольших нейтральных молекул: водород, метан, вода, монооксид и диоксид углерода, монооксид азота, хлористый водород, сероводород, метанол и т.д.
При объяснении или предсказании масс-спектрометрического поведения органических молекул часто пользуются «четно-электронным» правилом и правилом Стивенсона-Одье.
«Четно-электронное» правило заключается в том, что ион-радикалы (нечетное число электронов) могут элиминировать или радикалы, или четно-электронные нейтральные молекулы, тогда как ионы (четное число электронов) могут терять лишь нейтральные четно-электронные частицы, но не радикалы (рис. 3).

Рис. 3 «Четно-электронное» правило масс-спектрометрической фрагментации ион-радикалов и ионов
Правило Стивенсона-Одьевпервые было установлено для алканов, а позднее распространено и на более сложные органические молекулы. В современной трактовке правило звучит следующим образом: фрагмент с большей энергией ионизации (ЭИ) имеет большую склонность к удержанию неспаренного электрона. Следовательно, вероятность образования иона с меньшей энергией ионизации будет больше.
Перегруппировочные ионы.Ионы, образующиеся из первоначальной молекулы путем перестройки ее структуры, называют перегруппировочными ионами.
Наиболее распространена перегруппировка Мак-Лафферти (рис. 4).

Рис. 4. Перегруппировка Мак-Лафферти
Условия протекания перегруппировки Мак-Лафферти:
1. Желательно наличие гетероатома в молекуле (необязательно).
2. Наличие π-системы (обычно двойная связь).
3. Наличие водорода у γ-атома (в γ-положении по отношению к группе С–R).
Перегруппировка атомов, не включающих атом водорода, называется скелетной. Примером перегруппировки с участием атомов водорода может служить перегруппировка неопентана (рис. 5).

Рис. 5. Перегруппировка неопентана с участием атомов водорода
Следует отметить, что представления о механизме образования перегруппировочных ионов основаны на различных допущениях, требующих более строгого теоретического и экспериментального подтверждения. В частности, в случае неопентана возможны несколько различных механизмов образования этильного катион-радикала.
Многозарядные ионы. Многозарядные ионы – ионы, имеющие заряд больший, чем 1 (2, 3 и т.д.). Соответственно, отношение m/z у них кратно меньше, чем у однозарядного иона, и возможно появление нецелочисленных масс.
В экспериментальных условиях вероятность получения многозарядных ионов невелика (за исключением метода электроспрей-ионизации), хотя для соединений некоторых классов, таких как ароматические, образование двухзарядных ионов довольно частое явление. Условием стабилизации многозарядного иона является максимальное разделение зарядов, происходящее, например, в молекулах конденсированных ароматических соединений. Пример разделения зарядов в многозарядных ионах показан на рис. 6.

Рис. 6. Разделение зарядов в многозарядных ионах
Многозарядные ионы также могут претерпевать фрагментацию.
Метастабильные ионы.Ионы, имеющие время жизни порядка 10-6-10-5с, называютсяметастабильными и претерпевают распад на ион и нейтральную частицу. Время жизни метастабильных ионов короче, чем время пролета через масс-анализатор. В результате зарегистрированное детектором соотношение массы к заряду изменяется, что приводит к образованию слабого уширенного (размытого) пика, при этом максимум пика, как правило, соответствует нецелочисленным значениям массовых чисел.
Регистрация в масс-спектре метастабильного иона в ряде случаев является полезной, т.к. позволяет доказать протекание конкретной реакции, связывающей «родительский» и «дочерний» ионы.
Основные направления фрагментации важнейших классов органических соединений
Общая строгая теория распада молекулярного иона отсутствует, т.к. для описания фрагментации требуется знание электронных состояний ионов разных типов и вероятностей перехода между этими состояниями.
Вместе с тем накопленный массив экспериментальных данных позволил сформировать качественные полуэмпирические представления о направлениях фрагментации, которые используют принципы сохранения структуры молекулы при ее ионизации (принцип Франка-Кондона) и минимума структурных изменений в результате разрыва связей при фрагментации.
Общие принципы фрагментации основных классов органических соединений под действием ЭИ:
1. Для неразветвленных соединений относительная интенсивность молекулярного иона максимальна и понижается по мере увеличения разветвленности.
2. С увеличением молекулярного веса в гомологическом ряду относительная интенсивность молекулярного иона обычно уменьшается, за исключением эфиров жирных кислот, которые часто встречаются, например, в экстрактах растений.
3. Распад идет преимущественно по разветвленным атомам углерода. Чем больше разветвление, тем вероятнее распад. Это результат повышения стабильности третичного карбониевого катиона по сравнению со вторичным, который, в свою очередь, стабильнее первичного.
4. Наибольший заместитель в разветвленной цепи отщепляется легче в виде радикала, т.к. радикал с длинной цепью может легче стабилизироваться за счет делокализации одного электрона.
5. Двойные связи, циклические структуры и особенно ароматические и гетероароматические циклы стабилизируют молекулярный ион и таким образом повышают вероятность его появления и уменьшают фрагментацию.
6. Двойные связи способствуют аллильному распаду и дают резонансно-стабилизированный аллильныйкарбониевый ион.
7. Насыщенные циклы имеют тенденцию терять боковые цепи при α-связи. Это особый случай разветвления. Положительный заряд остается на фрагменте цикла.
8. Ненасыщенные циклы могут подвергаться ретродиеновому распаду.
9. Распад ароматических алкилзамещенных соединений наиболее вероятен по β-связи относительно цикла. В результате получается резонансно-стабилизированный бензил-ион, способный к перестройке в тропилий-ион.
10. Связи С–С, следующие за гетероатомом, часто разрываются, оставляя заряд на фрагменте, содержащем гетероатом, несвязывающие электроны которого обеспечивают резонансную стабилизацию.
11. Распад часто происходит через удаление небольших стабильных молекул, например, CO, NH3, H2O, HCN, H2S, олефинов, спиртов или меркаптанов, кетенов.
В масс-спектрах часто присутствует серия пиков фрагментных ионов, различающихся на гомологическую разность (СН2), т.е. 14 а.е.м. Гомологические серии ионов характерны для каждого класса органических веществ и несут важную информацию о структуре исследуемого вещества.
Далее представлена общая характеристика масс-спектров, снятых в условиях ЭИ, для различных классов органических соединений, в том числе гетероциклических соединений.
Алканы
Молекулярный ион. Малой интенсивности, интенсивность сигнала уменьшается с увеличением длины цепи или степени разветвленности молекулы. В спектрах сильно разветвленных алканов пик M+• может отсутствовать вовсе.
Серии ионов. Алкановая серия [CnH2n+1]+ (m/z 29, 43, 57, 71, 85 …). Максимальными в спектрах являются пики ионов с m/z 43 (С3Н7+), 57 (С4Н9+), 71 (С5Н11+). Алкановая серия ионов сопровождается алкеновой серией [CnH2n-1]+ (m/z 27, 41, 55, 69 …) и серией пиков [CnH2n]+• с четной массой, которые достаточно интенсивны.
Фрагментация. Ионы [CnH2n+1]+ могут образовываться как в результате простого гомолитического разрыва любых С–С-связей, так и в результате сложных перегруппировочных процессов.
Алкильные фрагменты большого размера (сС> 4) образуются, как правило, при прямом распаде. Их дегидрогенирование сопровождается перегруппировкой с участием атомов водорода.
Алкильные фрагменты меньшего размера (от С2до С4) образуются при вторичном распаде более крупных алкильных фрагментов. Следует отметить, что отщепление от M+• концевой СН3-группы в случае н-алканов происходит слабо, тогда как в случае разветвленных алканов появляется пик иона [М–СН3]+.
Алкены, диены и полиены
Молекулярный ион. Более интенсивные пики M+•, чем в случае алканов.
Серии ионов. Наиболее характеристические пики в спектрах соответствуют ионам алкеновой серии [CnH2n-1]+ (m/z 27, 41, 55, 69 …). Наряду с ними присутствуют пики ионов алкановой серии [CnH2n+1]+, которые имеют значительную интенсивность в области низких значений m/z, а также пики алкеновых «псевдомолекулярных» ионов [CnH2n]+•.
Сопряженные диеновые углеводороды распадаются под действием ЭИ аналогично моноолефинам и образуют преимущественно группы ионов состава [C3Hх]+ и [C5Hх]+.
Фрагментация. Преобладает фрагментация с образованием алкильных остатков и нейтральных алкенов. Образование алкеновой серии ионов обусловлено аллильным распадом. Нечетноэлектронные фрагменты [CnH2n]+• образуются в результате перегруппировки Мак-Лафферти. Определение положения С=С-связи затруднено. Не поддается установлению также принадлежность соединения к цис- или транс- изомерам. Однако, молекулярный ион, как правило, более интенсивен в спектре транс-изомера.
Алкины
Молекулярный ион. Интенсивность пиков M+• крайне низка и достигает больших значений лишь для низших членов гомологического ряда. Начиная с нормального 1-пентина и выше пик M+• практически отсутствует, но довольно заметен пик иона [M-1]+•. По мере перемещения тройной связи к центру цепи стабильность M+• увеличивается.
Серии ионов. Характерной для алкинов является гомологическая серия ионов [CnH2n-3]+ (m/z 25, 39, 53, 67 …). В масс-спектрах 1-, 2-, 3- и 4-алкинов наиболее интенсивны пики с m/z 81, 95, 109 и 123, соответственно.
Фрагментация. Основной механизм образования ионов серии [CnH2n-3]+ аналогичен аллильному разрыву связи в M+• алкенов. В данном случае образуются пропаргильные ионы, стабилизированные эффектом резонанса, но в меньшей степени, чем аллильные.
В отличие от алканов и алкеновперегруппировочный процесс (рис. 7), сопровождающийся образованием шестичленного циклического иона, позволяет делать выводы о положении тройной связи в исходной молекуле.

Рис. 7. Скелетная перегруппировка в ряду алкинов
Ароматические углеводороды
Молекулярный ион. Молекулярные ионы незамещенного бензола и его полициклических аналогов характеризуются максимальными по интенсивностям пиками в спектре вследствие стабилизации заряда ароматической системой. С увеличением числа конденсированных колец интенсивность иона M+• возрастает. В случае замещенных ароматических углеводородов молекулярные ионы также характеризуются интенсивными пиками в спектрах.
Серии ионов. В спектрах регистрируются серии ионов [CnHn]+• и [CnHn±1]+ (m/z 39, 51-53, 63-65, 75-77 …).
Фрагментация. При распаде M+• незамещенного бензола происходит последовательное элиминирование Н• и Н2, что приводит к пикам [M-1]+, [M-Н2]+•, [M-3]+, [M-5]+ с убывающей интенсивностью. Дальнейшая фрагментация состоит в отщеплении ацетилена С2Н2 (Δm 26) и С3Н3+ (Δm 39). Аналогичные процессы характерны для любых незамещенных полициклических ароматических углеводородов.
В масс-спектрах алкилбензолов основные направления фрагментации связаны с бензильным разрывом связей, в результате чего появляется интенсивный (часто максимальный) пик стабильного тропилий-катиона [C7H7]+ (m/z 91). Этот катион можно считать первым в гомологической серии характеристических для алкилбензолов ионов с общей формулой Ph(CH2)n+. При дальнейшем элиминировании от тропилий- катиона двух нейтральных молекул ацетилена появляются пики ионов с m/z 65 и m/z 39 (рис. 8).

Рис. 8. Фрагментация алкилбензолов через процесс бензильного разрыва
В случае монозамещенных алкилбензолов распад молекулярного иона может также осуществляться по механизму перегруппировки Мак-Лафферти. В результате в масс-спектре появляется нечетно-электронный ион толуола (m/z 92) с интенсивностью, часто сравнимой с интенсивностью тропилий-катиона (m/z 91).
Данная перегруппировка возможна в том случае, если цепь заместителя является неразветвленной и состоит из трех или более атомов и, по крайней мере, одно орто-положение свободно.
На основании двух описанных процессов (бензильный разрыв и перегруппировка Мак-Лафферти) можно устанавливать структуры изомерных ароматических углеводородов.
Основные закономерности, отмеченные для моноалкилбензолов, наблюдаются и в случае полиалкилзамещенных. Для полиметилбензолов основной процесс фрагментации связан с выбросом из M+• радикала СН3. Примечательно, что в масс-спектре 1,2-диэтилбензола максимальным является пик иона [М-C2H5]+.
Алифатические спирты
Молекулярный ион. Обычно имеет слабую интенсивность. В спектрах третичных, а иногда и вторичных спиртов пик M+• часто отсутствует вовсе.
Нестабильность M+• вызвана благоприятными процессами фрагментации, инициируемыми ионизированной гидроксильной группой.
Серии ионов. Ионы характеристической «спиртовой» серии [CnH2n+1O]+ имеют значения m/z 31 (преобладает в первичных спиртах), 45, 59, 73, 87 и т.д. Пики ионов этой серии в масс-спектрах могут быть как очень интенсивными, так и едва заметными. Наряду с пиками спиртовой серии высокую интенсивность будут иметь пики ионов алкановой и алкеновой серий, в особенности при распаде неразветвленных соединений. В результате термической деструкции молекул, а также за счет обычных процессов масс-спектрометрической фрагментации M+• в масс-спектрах возникают также ионы [M-Н2]+•, [M-Н2О]+•, [M-Н2, -Н2О]+•.
Фрагментация. Наиболее характерный процесс фрагментации M+• спиртов связан с α-распадом и последующими перегруппировочными процессами с выбросами молекул олефинов. При этом в масс-спектрах первичных спиртов наблюдается характерный пик, обусловленный ионом CH2=+ОН (m/z 31); у вторичных и третичных спиртов – характерные пики, обусловленные ионами RCH=+ОН (m/z 45, 59, 73 …) и RR’C=+ОН (m/z 59, 73, 87 …), соответственно.
Важным направлением распада спиртов является элиминирование молекулы воды. Атом водорода, отщепляющийся вместе с гидроксильной группой, может захватываться наиболее вероятно из положений 2, 3 и 4. В результате этого процесса возникают олефиновые или циклановые ионы (рис. 9).

Рис. 9. Распад молекулярного иона спиртов, сопровождающийся элиминированием воды
Выброс молекулы воды может сопровождаться элиминированием молекулы этилена (отщепляются α- и β-атомы углерода), что обуславливает появление пика [M-(алкен + Н2О)]+•, т.е. [M-46]+•, [M-74]+•, [M-102]+•. По значению m/z образующегося иона можно судить о наличии разветвлений у α- и β-атомов углерода.

Рис. 10. Распад молекулярного иона спиртов, сопровождающийся элиминированием воды и этилена
Бензиловые спирты
Молекулярный ион. Интенсивный пик.
Фрагментация. Характерно элиминирование атома водорода Н• с последующим отщеплением молекулы СО и выбросом молекулы водорода с образованием фенил-катиона C6H5+ . Следует отметить, что отрыв атома водорода может идти от любого из атомов углерода, что подразумевает трансформацию M+• до распада.
Другое направление фрагментации – отщепление гидроксильной группы с образованием стабильного тропилиевого катиона (m/z 91) (рис. 11).
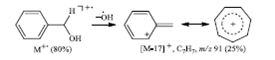
Рис. 11. Распад молекулярного иона бензилового спирта, сопровождающийся элиминированием группы ОН•
Фенолы
Молекулярный ион. Интенсивный пик, в самом феноле – основной.
Серии ионов. Основная серия ионов – ароматическая серия [CnHn]+• и [CnHn±1]+ (m/z 39, 51-53, 63-65, 75-77 …). Пик m/z 69 (О=ССН=С=О) характерен для 1,3-дигидроксильного производного.
Фрагментация. Специфический «фенольный» распад заключается в элиминировании из M+• частиц СО (Δm 28) и НСО• (Δm 29). Важную роль играет также потеря Н2О2 (Δm 34), Н2О (Δm 18), НО• (Δm 17) и О• (Δm 16). Элиминирование молекулы воды обусловлено орто-эффектом и наблюдается только для орто-замещенных фенолов.
Дата добавления: 2018-06-01; просмотров: 3823; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
