Интерполиэлектролитные реакции.
В зависимости от силы исходных полиэлектролитов могут быть получены комплексы различной устойчивости и разного внешнего вида.
Так, например, между полимерными электролитами, имеющими малую плотность заряда на макромолекулах, т.е. с большим молекулярным весом на одну ионную группу (300 и более), образуются так называемые коацерватные комплексы. При этом происходит разделение системы на две жидкие фазы, одна из которых обогащена макромолекулярными компонентами и носит название коацервата. Коацерватные комплексы очень чувствительны к присутствию посторонних электролитов. Способность низкомолекулярных солей разрушать коацерватные комплексы обусловлена экранирующим действием малых ионов, причем эффективность электролита тем больше, чем больше заряд катиона или аниона. При взаимодействии солей полимерных кислот и оснований с молекулярной массой меньше 500 на одну ионную группу полиэлектролитный комплекс высаживается из раствора в виде геля или мелкодисперсного сравнительно мало сольватированного осадка.
Взаимодействие в растворах между электростатически комплементарными полиэлектролитами с высокой плотностью заряда на цепях приводит к образованию ПЭК, способных при соотношении противоположно заряженных групп, равном 1:1, выделяться из раствора в виде сравнительно мало сольватированных осадков, называемых стехеометричными ПЭК (С-ПЭК). Они нерастворимы ни в одном из известных растворителей, способны ограниченно набухать в воде. Интерполимерные соединения, также являющиеся продуктами реакций между полиэлектролитами с высокой плотностью заряда на цепях, при соблюдении определенных условий не выпадают в осадок. Следовательно, они ведут себя как обычные растворимые полиэлектролиты. Такие комплексы носят название нестехиометричные ПЭК (Н-ПЭК).
|
|
|
Кооперативные взаимодействия между макромолекулами
Полиэлектролитов.
Очевидно, что исследование свойств и структуры полиэлектролитных комплексов невозможно без понимания механизма реакций между полиэлектролитами. Специфичность таких реакций определяется кооперативным характером взаимодействия полиэлектролитов и является причиной существенного сдвига равновесия в ионных химических реакциях между ними по сравнению с теми же реакциями их низкомолекулярных аналогов. В качестве примера можно рассмотреть реакцию обмена между слабой полиакриловой кислотой (ПАК) и поливиниламином (ПВА) в кислых и щелочных средах:

(А)

(Б)
В обеих реакциях смешение растворов компонентов, взятых в эквимолярных количествах, сопровождается заметным сдвигом равновесия вправо, т.е. фактически слабая полимерная кислота эффективно вытесняет сильную низкомолекулярную кислоту из ее соли с полимерным основанием, а слабое полимерное основание, реагируя с солью полимерной кислоты, образует щелочь. Следует отметить, что равновесие аналогичных реакций в случае низкомолекулярных модельных соединений практически полностью сдвинуто влево. Более того, не удается наблюдать образование комплекса и в том случае, если только один из компонентов является полимером. Одним из продуктов реакций (А) и (Б) является полиэлектролитный солевой комплекс, нерастворимый в воде. Это обусловлено гидрофобизацией макромолекул, так как ионогенные группы, ответственные за растворимость полимеров в водных растворах, оказываются блокированными.
|
|
|
Степень превращения θ в реакции между полиэлектролитами можно определить как долю функциональных групп, связанных солевыми связями, от общей концентрации функциональных групп любого компонента (при эквимольных соотношениях противоположно заряженных полиэлектролитов в смеси):
 , (5.1),
, (5.1),
где CK- концентрация функциональных групп, образующих солевые связи (моль/л),
|
|
|
CO- исходная концентрация любого полиэлектролита (моль/л).
При любом значении рН раствора можно рассчитать θ по формуле:
 , (5.2),
, (5.2),
где qNaOH – количество введенной щелочи, моль,
VO - объем реакционной смеси, л;
[H+] – концентрация протонов в растворе, моль/л,
[H+]ПК – концентрация протонов в растворе, создаваемая непрореагировавшей поликислотой, моль/л.
Поскольку третий член уравнения [H+]ПК не поддается экспериментальному определению, то он может быть рассчитан по формуле:
 , (5.3)
, (5.3)
В этом выражении мы допускаем, что диссоциация полимерной кислоты описывается kхар.пк, такое допущение справедливо для области рН ≤ рН водного раствора поликислоты той же концентрации.
Безусловный интерес представляют реакции обмена между этими полиэлектролитами в щелочной среде (реакция Б). В таких растворах полимерная кислота практически нацело ионизована, а макромолекулы полиоснования незаряжены.
Из кривой потенциометрического титрования смеси слабого полиоснования и соли поликислоты можно рассчитать θ при любом значении рН. Для этого воспользуемся уравнением:
|
|
|
 , (5.4),
, (5.4),
где qHCl – количество введенной кислоты, моль,
[OH-] - концентрация гидроксильных ионов в реакционной смеси, моль/л,
[OH-]по – концентрация гидроксильных ионов, создаваемая непрореагировавшим основанием, моль/л.
[OH-]по рассчитывается по формуле:
 , (5.5)
, (5.5)
где Кw – ионное произведение воды,
Кхар.по – характеристическая кислотная константа ионизации полиоснования.
Расчет по формуле (5.5) справедлив только при рОН ≥ рОН раствора полиоснования той же концентрации.
Зависимости степени превращения θ от рН, приведенные на рис. 5.1, свидетельствуют о том, что образование полиэлектролитных комплексов происходит в узком интервале рН растворов, что указывает на кооперативность процесса. Соответственно, область рН, в которой образовавшийся ПЭК устойчив, оказывается довольно широкой. Существенной особенностью этих реакций является то, что при достаточно высоких степенях полимеризации реагентов, равновесие реакций контролируется локальной концентрацией функциональных групп и не зависит от общей концентрации полимеров в растворе. Поэтому, даже при значительном (до двух порядков) изменении исходной концентрации полиэлектролитов в растворе, зависимости степени превращения от рН совпадают, если соотношение полимерных компонентов постоянно.

Рис. 5.1 Зависимость степени превращения от рН в реакциях обмена между поликислотой и солью полиоснования (1) и полиоснованием и солью поликислоты (2)
Другим примером кооперативной реакции с участием полиэлектролитов является образование полимерного комплекса полиметакриловой кислоты (ПМАК) с полиэтиленгликолем (ПЭГ):

В этом случае наблюдается образование еще более устойчивых комплексов, так как макромолекулы при взаимодействии образуют водородные связи. Образование таких связей, а также гидрофобные взаимодействия в водных растворах приводят к стабилизации комплекса и сворачиванию частиц в компактные клубки. Поэтому за реакцией можно следить по изменению вязкости раствора. При добавлении к водному раствору полиметакриловой кислоты раствора полиэтиленгликоля вязкость резко падает, достигает минимального значения при эквимольном, считая на моль звена, соотношения компонентов и вновь возрастает при добавлении избытка полиэтиленгликоля (рис.5.2).

Рис. 5.2 Зависимость приведенной вязкости водных растворов смесей полиметакриловой кислоты (ПМАК) и полиэтиленгликоля (ПЭГ) от состава смеси.
Установлено, что образование устойчивых комплексов возможно лишь при достижении некоторой критической молекулярной массы компонентов, соответствующей так называемой критической длине кооперативного участка. Устойчивость поликомплексов также существенно зависит от длины взаимодействующих макромолекул, что особенно наглядно проявляется в реакциях типа: 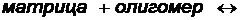
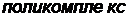 ,
,
где матрица и олигомер комплементарные макромолекулы, то есть молекулы, содержащие группы, обладающие химическим сродством друг к другу; длина цепей олигомера значительно меньше длины цепей матрицы.
Константа равновесия в таких реакциях прогрессивно увеличивается с ростом длины цепи олигомера. Взаимодействие n малых молекул с полимерной цепью может дать выигрыш энергии n∆Hзв, где ∆Hзв - энтальпия образования одной связи и проигрыш энтропии-∆Sзв. Если цепь олигомера из n звеньев взаимодействует с полимерной молекулой, то выигрыш энергии в первом приближении оказывается таким же, n∆Hзв, а проигрыш энтропии меньше, так как звенья уже связаны в цепь. Это и приводит к смещению равновесия в сторону образования поликомплекса.
Если в системе присутствуют молекулы одного и того же олигомера, но разной длины, то матрица должна избирательно связываться в поликомлексе с наиболее длинными цепями олигомера. Если два разных олигомера одинаковой длины вступают в реакцию с матрицей, то последняя peaгиpyeт в первую очередь с тем олигомером, для которого энергия образования одной связи больше.
Кроме собственно энергии связи, устойчивость поликомплекса зависит и от других типов взаимодействий, в частности от взаимодействия между удаленными участками матрицы, так называемые "объемные взаимодействия". Изменение температуры и (или) природы растворителя влияет на суммарную энергию Гиббса комплексообразования и, соответственно, на прочность комплекса. Так, в стабилизации комплекса полиметакриловой кислоты с полиэтиленгликолем в водной среде существенную роль играют гидрофобные взаимодействия, поэтому с повышением температуры прочность комплекса возрастает. При переходе от водной к водно-спиртовой среде изменяется характер взаимодействия, и зависимость устойчивости поликомплекса от температуры меняет свой ход на обратный.
Кооперативное взаимодействие типа '"олигомер-полимер'" и "полимер-полимер" играют важную роль в стабилизации различных биологических структур.
При образовании амфифильных комплексов полимер- ПАВ с переменным лиофильно-лиофобным балансом реакция между компонентами также носит кооперативный характер. Однако необходимым условием формирования таких комплексов является формирование в частицах комплексов мицелл ПАВ. При этом критическая концентрация мицеллообразования ионов ПАВ уменьшается на несколько порядков по сравнению с ККМ в отсутствии ПЭ. Более того, формирование мицелл на полимерной молекуле в ряде случаев вызывает существенное изменение чисел агрегации ионов ПАВ, морфологии мицеллы и ее свойств, например, соллюбилизирующей способности. В зависимости от лиофильно-лиофобного баланса частиц комплекса, определяемого природой компонентов и условием проведения реакции (состав реакционной смеси, температура, рН, ионная сила, концентрационный режим раствора полимера и пр.), комплексы полимер-ПАВ могут быть как растворимыми, так и нерастворимыми в водных и водно-солевых средах. Основной особенностью фазового разделения в растворах этих комплексов, по сравнению с растворами обычных полимеров, является то, что образование концентрированной фазы сопровождается реакцией перераспределения солевых связей между частицами комплекса.
Экспериментальная часть
Лабораторная работа №9
Дата добавления: 2018-06-01; просмотров: 631; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
