Уравнение состояния идеального газа. Изопроцессы. Газовые законы.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона:  где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная.
где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная.
Уравнение, устанавливающее связь между давлением, объемом и температурой газов, было получено французским физиком Б. Клапейроном и русским ученым Д. И. Менделеевым, поэтому уравнение состояния газа называется уравнением Менделеева — Клапейрона.
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа.
Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const. Для данной массы газа произведение давления на объем есть величина постоянная.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: при V = const, 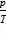 = const.. Для данной массы газа отношения давления к температуре есть величина постоянная.
= const.. Для данной массы газа отношения давления к температуре есть величина постоянная.
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид  = const при р = const и называется законом Гей-Люссака:для данной массы газа отношения объема к температуре есть величина постоянная.
= const при р = const и называется законом Гей-Люссака:для данной массы газа отношения объема к температуре есть величина постоянная.
Все процессы можно изобразить графически.
|
|
|



Билет № 11
Объясните процесс испарения и конденсации. Дайте определение насыщенных и ненасыщенных паров. Дайте определение влажности воздуха и назовите способы её измерения.
Испарение- это парообразование, происходящее со свободной поверхности жидкости.
Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем одни из них движутся быстрее, другие - медленнее. Вылететь наружу им мешают силы притяжения друг к другу. Если, однако, у поверхности жидкости окажется молекула с достаточно большой кинетической энергией, то она сможет преодолеть силы межмолекулярного притяжения и вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
|
|
|
Поскольку при испарении из жидкости вылетают наиболее быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. В результате этого температура испаряющейся жидкости понижается: жидкость охлаждается. Именно поэтому, в частности, человек в мокрой одежде чувствует себя холоднее, чем в сухой (особенно при ветре).
Одновременно с испарением на поверхности жидкости происходит и обратный процесс - конденсация. Конденсация происходит из-за того, что часть молекул пара, беспорядочно перемещаясь над жидкостью, снова возвращается в нее.
Насыщенный и ненасыщенный пар
Если сжимать газ в сосуде при постоянной температуре, то при некотором его объеме в сосуде появится жидкость и перестанет меняться давление, так как концентрация молекул над жидкостью станет постоянной за счет наступления динамического равновесия между жидкостью и паром. Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным.Под динамическим равновесием жидкости и пара понимают такое их состояние, когда число молекул, покидающих поверхность жидкости, равно в среднем числу молекул пара, возвращающихся за то же время в жидкость. Название «насыщенный» подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
|
|
|
Зависимость давления насыщенного пара от температуры.
Давление насыщенного пара зависит от температуры, но не зависит от объема.
Влажность воздуха -физическая величина, характеризующая содержание в воздухе водяного пара. Относительная влажность воздуха – это отношение парциального давления (или концентрации молекул) водяного пара, содержащегося в воздухе при данной температуре, к давлению (концентрации) насыщенного пара при той же температуре. Выражается:

Относительная влажность воздуха показывает, насколько водяной пар в данных условиях близок к насыщению. Именно от этого зависит интенсивность испарения воды и потеря влаги живыми организмами. Для человека наиболее благоприятна относительная влажность, равная 40–60%.
Измерение влажности
Для измерения влажности используют зависимость различных параметров веществ от влажности воздуха. Таким параметром может служить, например, скорость испарения воды.
|
|
|
С помощью психрометра фиксируют разницу температур двух термометров – сухого и влажного .
По этой разнице и температуре сухого термометра устанавливают влажность воздуха по психрометрической таблице.
Билет № 12
Дата добавления: 2018-06-01; просмотров: 1544; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
