Приготовление растворов, реактивов, индикаторов, титрованных и эталонных растворов. Учёт расхода реактивов и отчётность.
Табель рабочего времени студента-практиканта.
|
Дата | Начало и окончание рабочего дня |
Выполненная работа |
Затраты времени
| Подписи | |
| Студента | Руководите ля | ||||
| 13.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Знакомство с размещением производственных и вспомогательных помещений, оборудованием и задачами контрольно-аналитического рабочего кабинета аптеки, оснащением рабочего места провизора аналитика, порядком ведения документации. Оформление дневника. Анализ воды для инъекций. Контроль качества вымытой посуды (приказ МЗ РФ №214), полноты смыва моющих средств, нормативные документы, регистрация результатов. Оформление дневника. Анализ воды очищенной. Анализ раствора Натрия хлорида 0,9% - 200 мл.до и после стерилизации. Приготовление реактивов. Оформление дневника. | 6 ч. 12 м. 1 ч. | ||
| 14.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной, воды для инъекций. Приготовление эталонного раствора. Приготовление реактивов. Анализ воды очищенной. Количественный анализ калия йодида 5%, кофеина бензоата натрия 3% Оформление дневника. Анализ воды очищенной. Приготовление и пополнение реактивов. Учёт и отчётность реактивов. Оформление дневника. | 2 ч. 4 ч. 12 м. 1 ч. | ||
| 15.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Магния сульфата (концентрат) 2% - 200 мл. Анализ внутриаптечной заготовки, концентратов из бюреточной системы. Анализ дефектуры. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Цинка сульфата 2% - 200 мл. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ раствора Дикаина 0,3% - 10 мл. Анализ внутриаптечной заготовки, концентратов из бюреточной системы. Анализ дефектуры. Оформление дневника. | 2 ч. 3 ч. 12 м. 1 ч. 1 ч. | ||
| 16.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды для инъекций. Качественный и количественный анализ лекарственной формы раствора Люголя 1% - 50 мл. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Калия перманганата 0,05% - 100 мл. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Натрия бромида 3% - 200 мл. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора кислоты аскорбиновой 1% - 200 мл. Проверка сроков хранения ГЛС и ВАЗ. Оформление дневника. | 3 ч. 12 м. 1 ч. 2 ч. 1 ч. | ||
| 17.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Эуфиллина 2% - 200 мл. Оформление дневника. Анализ воды очищенной. Знакомство с организацией хранения реактивов, лекарственных веществ, лекарственных препаратов заводского и аптечного производства, лекарственного растительного сырья, внутриаптечной заготовки, концентрированных растворов. Контроль за сроками хранения, НД. Оформление дневника. | 2 ч. 4 ч. 12 м. 1 ч. | ||
| 20.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Глюкозы 5% - 200 мл. Приготовление реактивов: кислота хлороводородная, кислота азотная разведенная. Оформление дневника. Анализ воды очищенной. Знакомство с организацией, содержанием приемочного контроля, его документальным оформлением. Экспертиза протоколов соответствия и сертификатов. Оформление дневника. Анализ воды очищенной. Проведение приемочного контроля готовых лекарственных препаратов, поступивших в аптеку. Размещение по местам хранения. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Перекиси водорода 3% - 100 мл. Оформление дневника. | 2 ч. 3 ч. 12 м. 1 ч. 1 ч. | ||
| 21.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Меди сульфата 2% - 200 мл. Оформление дневника. Анализ воды для инъекций. Качественный и количественный анализ лекарственной формы раствора Фурациллина 0,02% - 10 мл. Анализ дефектуры ВАЗ. Оформление дневника. Анализ воды очищенной. Сбор и утилизация сливов, содержащих катионы серебра, ртути. НД, учет и отчетность по «движению» солей драгоценных металлов. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Колларгола 3% - 100 мл. Анализ внутриаптечной заготовки, концентратов из бюреточной системы. Анализ дефектуры. Оформление дневника. | 1 ч. 1 ч. 4 ч. 12 м. 1 ч. | ||
| 22.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора магния сульфата 33% - 400 мл. Приготовление реактивов. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора натрия гидрокарбонат 3% - 200 мл. Оформление дневника. Организация метрологического контроля весоизмерительных приборов и химической измерительной посуды. Нормативные и регистрационные документы по метрологическому контролю. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора кальция хлорид 5% - 400 мл. Анализ внутриаптечной | 2 ч. 4 ч. 12 м. 1 ч. | ||
| 23.02.2017 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Анализ воды очищенной. Качественный и количественный анализ лекарственной формы мазь салициловая 2% - 10,0 Анализ дефектуры. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Натрия цитрат 3,8% - 20 мл. Оформление дневника. Анализ воды очищенной. Качественный и количественный анализ лекарственной формы раствора Кальция хлорид 50% (концентрат). Анализ внутриаптечной заготовки, концентратов из бюреточной системы. Анализ дефектуры. Оформление дневника. | 2 ч. 2 ч. 12 м. 2 ч. 1 ч. | ||
| 24.02.2015 | 8:00 – 16:12 Обед с 12:00 до 13:00 | Оформление отчета по практике, аттестационного свидетельства по практическим навыкам. Оформление дневника. | 2 ч. 4 ч. 12 м. 1 ч. | ||
Руководитель:
|
|
|
|
|
|
|
|
|
|
|
|
Печать:
Протокол № 1
Должностная инструкция
Провизора – аналитика
I. Общие положения
1.1. Настоящая должностная инструкция определяет должностные обязанности, права и ответственность провизора-аналитика.
1.2. Провизор – аналитик относится к категории специалистов.
1.3. На должность провизора-аналитика назначается лицо, имеющее высшее профессиональное образование по специальности "Фармация", послевузовское и (или) дополнительное профессиональное образование и сертификат специалиста по специальности "Фармацевтическая технология", "Фармацевтическая химия и фармакогнозия" без предъявления требований к стажу работы.
Провизор, занятый контролем качества лекарственных средств, изготовляемых в условиях аптек (провизор-аналитик), должен быть аккредитован и иметь сертификат специалиста, подтверждающий степень соответствия его профессионального уровня установленным требованиям.
1.4. Назначение на должность провизора-аналитика и освобождение от нее производится приказом ректора университета по представлению руководителя соответствующего структурного подразделения; иного должностного лица.
1.5. Провизор -аналитик должен знать:
1.5.1. основы законодательства Российской Федерации об охране здоровья граждан и соответствующие директивные документы;
1.5.2. теоретические основы фармацевтического анализа;
1.5.3. общие статьи Государственной Фармакопеи, приказы и инструкции Минздрава России, инструктивно-методические материалы по изготовлению и контролю качества лекарственных средств, изготовляемых в аптеках, условия и правила хранения, в том числе содержащих ядовитые и наркотические лекарственные вещества;
1.5.4. систему организации службы контроля качества лекарственных средств; порядок проведения организационно-методической работы провизора-аналитика в аптеке;
1.5.5. правила прописывания и оформления рецептов (требований) в том числе, содержащих сильнодействующие, ядовитые и наркотические вещества, их высшие и разовые дозы;
1.5.6. технологию различных видов лекарственных форм, в том числе особенности изготовления стерильных лекарственных форм, концентратов, полуфабрикатов, внутриаптечной заготовки, настоев, отваров, суппозиториев и др.;
1.5.7. правила и нормы санитарно-гигиенического и противоэпидемического режима, правила асептики изготовления лекарственных средств, фармацевтический порядок в соответствии с действующими нормативными документами, приказами и инструкциями;
1.5.8. правила получения, сбора и хранения воды очищенной и воды для инъекций;
1.5.9. правила хранения лекарственных средств в аптеке.
1.5.10. условия хранения и сроки годности лекарственных форм, внутриаптечной заготовки, полуфабрикатов и концентратов, изготовленных в аптеке;
1.5.11. все виды внутриаптечного контроля лекарственных средств в соответствии с требованиями действующей Инструкции по контролю качества лекарственных средств, изготовляемых в аптеках (приемочный, письменный, опросный, огранолептический, физический, химический и контроль при отпуске);
1.5.12. экспрессные методы качественного анализа лекарственных средств в условиях аптеки. Краткую теорию флюоресцентного и микрокристаллического методов идентификации лекарственных веществ.
1.5.13. принцип работы приборов (микроскопа, ультрафиолетового облучателя);
1.5.14. количественный анализ лекарственных средств с использованием различных титриметрических, рефрактометрического, колориметрического, нефелометрического и фотоэлектроколориметрического методов. Применение перечисленных методов, их возможности и точность;
1.5.15. определение величины рН растворов с использованием индикаторных бумаг, индикаторов и потенциометрического метода. Принцип работы рН-метра, иономера, правила работы с ними;
1.5.16. методы определения концентрации этилового спирта в водно-спиртовых растворах;
1.5.17. инструкцию по оценке качества лекарственных средств, изготовляемых в аптеке, нормы допустимых отклонений при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках. Характер и причины ошибок при изготовлении и отпуске лекарственных средств. Порядок учета внутриаптечных ошибок;
1.5.18. лекарственные растения, произрастающие в области (крае), (календарные сроки сбора; общие правила и техника сбора; способы сушки) - требования Государственной Фармакопеи к качеству лекарственного растительного сырья. Показатели брака растительного сырья. Предварительный контроль лекарственного растительного сырья;
1.5.19. организацию рабочего места провизора-аналитика, оборудование контрольно-аналитического кабинета (стола);
1.5.20. номенклатуру титрованных растворов, реактивов, индикаторов, правила при их приготовлении. Составление заявок на реактивы и титрованные растворы;
1.5.21. затруднительные, нерациональные и несовместимые лекарственные прописи. Классификация несовместимостей. Порядок отпуска лекарственных средств при наличии несовместимостей или технологических затруднений;
1.5.22. учет работы провизора-аналитика аптеки. Ведение журналов регистрации результатов контроля;
1.5.23. нормы и правила охраны труда, техники безопасности и противопожарной безопасности.
1.5.24. правила внутреннего трудового распорядка;
1.6. В своей деятельности провизор-аналитик руководствуется:
1.6.1. Уставом университета.
1.6.2. Приказами руководства университета.
1.6.3. Распоряжениями главного врача и заместителя главного врача медицинского учреждения.
1.6.4. Коллективным договором Университета.
1.6.5. Положением о медицинском учреждении.
1.6.6. Настоящей должностной инструкцией.
1.7. Провизор-аналитик подчиняется непосредственно
_______________________ .
1.7.1. На время отсутствия провизора-аналитика (отпуск, болезнь, пр.) его обязанности исполняет лицо, назначенное в установленном порядке. Данное лицо приобретает соответствующие права и несет ответственность за ненадлежащее исполнение возложенных на него обязанностей.
II. Должностные обязанности
Провизор-аналитик обязан:
2.1. пользоваться справочной литературой, нормативными документами, приказами и инструкциями по организации и проведению контроля качества лекарственных средств в аптеке;
2.2. составлять план мероприятий организационно-методической работы, план занятий фармацевтического кружка;
2.3. руководить работой молодых специалистов и специалистов со средним фармацевтическим образованием, оказать необходимую консультацию по изготовлению, контролю, оформлению к отпуску и хранению лекарственных средств;
2.4. оказать помощь в освоении практических навыков студентам фармацевтических колледжей, техникумов и вузов;
2.5. провести проверку аптечного учреждения по всем вопросам, касающимся санитарного режима, технологии лекарственных средств, контроля их качества, условий хранения и сроков годности. В случае выявления нарушений довести до сведения руководства и сотрудников аптеки;
2.6. провести анализ выявленных ошибок, допущенных при изготовлении лекарственных средств; установить причины, вызвавшие ошибки, поставить в известность руководство аптеки и внести предложения для их предупреждения и устранения в дальнейшем;
2.7. организовать контроль за качеством лекарственных средств, использовать в работе эффективные методы труда, проявлять доброжелательность и такт в отношении к сотрудникам;
2.8. выявлять физические, химические и фармакологические несовместимости при изготовлении лекарственных форм; рассчитать высшие разовые и суточные дозы лекарственных веществ, входящих в состав различных лекарственных форм в зависимости от массы или возраста больного;
2.9. осуществить на практике все виды внутриаптечного контроля;
- определить подлинность лекарственных веществ с использованием цветных, флюоресцентных и микрокристаллических реакций (обнаружение катионов и функциональных групп);
2.10. выполнить анализ очищенной воды и воды для инъекций в соответствии с требованиями Государственной Фармакопеи; провести качественный анализ концентратов, полуфабрикатов, внутриаптечной фасовки; качественный анализ лекарственных веществ в лекарственных формах для инъекций и для новорожденных детей, в растворах для лечебных клизм, в глазных каплях и мазях, содержащих лекарственные вещества списка "А", в лекарственных формах сложного состава; провести определение некоторых стабилизирующих и изотонирующих веществ в лекарственных формах для инъекций и глазных каплях;
2.11. провести количественное определение вещества в растворе рефрактометрическим методом с использованием рефрактометрических таблиц и формул расчета;
2.12. выполнить количественное определение веществ в лекарственных формах с использованием фотоэлектроколориметрического, визуального колориметрического и нефелометрического методов; пользоваться формулами расчета при указанных методах анализа;
2.13. рассчитать массу навески лекарственного вещества, которая требуется для проведения анализа титриметрическим методом; рассчитать объем титрованного раствора, который потребуется для титрования заданной массы навески. Вычислить отклонение в процентах от прописанной массы и оценить качество изготовления проанализированной лекарственной формы;
2.14. пользоваться формулами расчета при титриметрических методах определения лекарственных веществ (в граммах, в процентах) в лекарственных формах (жидкие лекарственные формы, порошки, мази, суппозитории);
2.15. определить величину рН растворов с использованием индикаторных бумаг и потенциометрического метода;
2.16. определить концентрацию этилового спирта по плотности: спиртомером, денсиметром или ареометром; провести расчеты при получении водно-спиртовых растворов различной концентрации (алкоголеметрические таблицы);
2.17. провести регистрацию результатов анализа; в случае выявления неудовлетворительного изготовления лекарственной формы, установить причину ее возникновения и принять меры по устранению ошибок;
2.18. изготовить титрованные растворы, реактивы, индикаторы; определить коэффициент поправки титрованного раствора;
2.19. провести анализ лекарственного растительного сырья по показателю "Внешние признаки";
2.20. осуществить контроль за соблюдением условий хранения, сроков годности и правильности оформления воды очищенной, воды для инъекций, внутриаптечной заготовки, полуфабрикатов, концентратов, фасовки, лекарственных средств индивидуального изготовления;
2.21. пользоваться аппаратами и приборами при проведении физико-химических методов анализа; содержать в исправности приборы, аппараты и весовое хозяйство;
2.22. составлять отчет по установленной форме о работе контрольно-аналитического кабинета (стола) аптеки.
2.23. систематически повышать свою квалификацию.
III. Права
Провизор-аналитик вправе:
4.1. Знакомиться с проектами приказов руководства медицинского учреждения, касающимися его деятельности.
4.2. Вносить на рассмотрение руководства медицинского учреждения предложения по совершенствованию работы, связанной с предусмотренными настоящей должностной инструкцией обязанностями.
4.3. Сообщать руководству медицинскому учреждения о всех выявленных в процессе исполнения своих должностных обязанностей недостатках в производственной деятельности предприятия (его структурных подразделениях) и вносить предложения по их устранению.
4.4. Требовать от руководства медицинского учреждения оказания содействия в исполнении им его должностных обязанностей и прав.
IV. Ответственность
Провизор-аналитик несет ответственность:
5.1. За ненадлежащее исполнение или неисполнение своих должностных обязанностей, предусмотренных настоящей должностной инструкцией - в пределах, определенных действующим трудовым законодательством Российской Федерации.
5.2. За правонарушения, совершенные в процессе осуществления своей деятельности - в пределах, определенных действующим административным, уголовным и гражданским законодательством Российской Федерации.
5.3. За причинение материального ущерба - в пределах, определенных действующим трудовым и гражданским законодательством Российской Федерации.
Протокол № 2
Анализ натрия хлорида 0,9%.
(Natriichloridum 0,9%).
Rp.:Sol. Natriichloridi 0,9% - 200,0
D.S. Для инъекций.
Возьми: Раствор Натрия хлорида 0,9% - 200мл
Дай.Обозначь.Для инъекций.
1.Натрия хлорид: NaCl, Мм = 58,44 г/моль.
2.Вода очищенная: Н2О, Мм = 18 г/моль.
Компоненты совместимы.
В соответствии с приказом МЗ РФ №214 от 16.07.1997 « О контроле качества лекарственных средств изготавливаемых в аптечных организациях (аптеках).»
Обязательный контроль: органолептический, письменный, контроль при отпуске; полный химический контроль, включая измерение рН, контроль на механические включения – до и после стерилизации.
Дополнительный: опросный.
Исследуемый раствор отпускается во флаконах светлого стекла, объемом 200 мл.укупоренный резиновой пробкой и алюминиевым колпачком «под обкатку».
Vобщ=200 мл. S(доп)=±2% (200 ± 4 мл) (п. 2.5 приказ МЗ РФ №305 от 16.10.1997г.)
| Что определя- ется. | Методика работы, химизм реакций, расчеты. | Результат. |
| Описание. | Прозрачная, бесцветная жидкость, без запаха. | Соотв. ГФ ХI |
| Подлин-ность. Na+ | К 0,5мл р-ра добавляют 5кап пикриновой кислоты, наблюдаем осадок жёлтого цвета. | Соотв. ГФ ХI |
| Cl¯ | К 0,5мл р-ра добавляют 0,5мл HNO3 и несколько кап AgNO3, образуется белый осадок, растворимый в р-ре аммиака при его добавлении. NaCl + AgNO3 = NaNO3+ AgCl↓(осадок) AgCl↓ +2NH4OH = [Ag(NH3)2]Cl+ 2H2O | Соотв. ГФ ХI |
Количественное определение.
Метод: аргентометрия (по Мору).
Способ: прямое титрование.
Индикатор: хромат калия.
Среда: нейтральная.
Теоретическое обоснование метода: метод основан на осаждении хлорид ионов нитратом серебра.
Химизм:
NaCl+ AgNO3 = NaNO3+ AgCl↓
2AgNO3+К2СrО4 = Ag2СrО4+ 2КNО3
Методика: к 0,5мл исследуемого р-ра добавляют 1-2кап хромата калия и титруют 0,1 моль/л AgNO3 до оранжево-жёлтого окрашивания.
Расчеты:
T= Mm(в-ва) * С(титранта) / 1000 = 58,44 * 0,1 / 1000 = 0,005844;
V(np) = m(HAB) * %(B-BA) / T * 100% = 0,5 * 0,9% / 0,005844 * 100% = 0,77мл;
V(титранта) * T * V(общ) 0,76 * 0,00584429 * 200,0
Mф = ---------------------------- = ------------------------------------- = 1,78;
m(HAB) 0,5
S (абс) = Mф– А = 1,78 - 1,80 = 0,02;
S (абс) 0,02
S (отн) = -------- * 100% = -------- * 100% = 1,1%.
A 1,8
В соответствии с приказом МЗ РФ №305 от 16.10.1997г. «О нормах отклонений допускаемых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организациях» п.2.7. отклонение по массе входит в норму допускаемых отклонений:S(доп)=±5%
Вывод: исследуемая лекарственная форма приготовлена удовлетворительно.
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 3
Организация и контроль чистоты вымытой аптечной посуды.
Обработка стеклопосуды включает в себя следующие стадии:
1. Дезинфекцию
2. Мойку
3. Ополаскивание
4. Сушку и стерилизацию
5. Контроль качества обработки
1. Дезинфекция - комплекс мероприятий, направленных на уничтожение возбудителей инфекционных заболеваний и разрушение токсиновна объектах внешней среды. Для её проведения обычно используются химические вещества, например, формальдегидили гипохлорит натрия, растворы органических веществ, обладающих дезинфицирующими свойствами: хлоргексидин, ЧАСы, надуксусная кислота. Дезинфекция уменьшает количество микроорганизмов до приемлемого уровня, но полностью может их и не уничтожить. Является одним из видов обеззараживания.
Аптечная посуда, бывшая в употреблении (в том числе поступившая от населения) в обязательном порядке подвергается дезинфекции.
Для дезинфекции используется 1% раствор активированного хлорамина с погружением посуды на 30 минут. Дез.растворы готовятся в ёмкостях (банках) из стекла или пластмассы в количестве, необходимом для полного погружения обрабатываемой посуды. Хранятся приготовленные дез.растворы не более суток. После дезинфекции посуда промывается проточной водой до исчезновения запаха дез.средства, затем подвергается мойке растворами моющих средств
Мойка аптечной посуды
Аптечная посуда после дезинфекции замачивается в растворе имеющегося моющего средства соответствующей концентрации:
· Горчица (порошок) – 5%
· Натрия гидрокарбонат – 0,5%
· СМА – 1%
· «Лотос», «Астра» - 0,5%
· «Прогресс» - 0,2%
· «Посудомой» - 0,5%
Моющее средство растворяется в воде, подогретой до 50-60 0С. Посуда замачивается в растворе в течение 25-30 минут при полном погружении. В этом же растворе посуда моется при помощи ёршика.
Для аптечной посуды используется 0,5% раствор хлорамина, 0,1% раствор ДП, 2% или 3% раствор перекиси водорода с добавлением 0,5% раствора моющего средства. Посуда полностью погружается в тёплый раствор (50-60 0С), выдерживается в нём 15 минут, затем моется при помощи ёршика. После этого посуда промывается проточной водой до полного исчезновения запаха.
Ополаскивание
Проводится сначала водопроводной водой 5-7 раз, затем 1 раз водой очищенной.
Сушка и стерилизация
Чистая посуда сушится в сушильных шкафах и хранится в закрытых шкафах. Флаконы для инъекционных растворов, глазных капель – стерилизуются. Режим стерилизации: горячим воздухом при температуре 180 0С – 60 минут; насыщенным паром под давлением при температуре 120 0С – 45 минут. После этого посуда вынимается, закрывается стерильными пробками и используется для розлива растворов.
Контроль качества обработки
Проводится визуально (выборочно), флаконы просматриваются на отсутствие посторонних включений, пятен, подтёков, по равномерности стекания воды со стенок флакона после его ополаскивания. При обнаружении на флаконах жировых загрязнений проводится контроль с реактивом Судан 3, для этого внутренняя поверхность вымытой и высушенной посуды смачивается 3-5 мл красящего раствора, распределяется по исследуемой поверхности в течение 10 сек., затем быстро смывается обильной струёй воды. На внутренней поверхности посуды не должно оставаться жёлтых пятен и подтёков. Полнота смыва моющих и моющее-дезинфицирующих средств определяется по величине pH исходной воды, взятой для контроля смыва. Ориентировочно наличие моющих средств можно определить по розовому окрашиванию с фенолфталеином.
Приготовление красящего раствора: в 70 мл нагретого до 60 0С 90% спирта растворяется по 0,2 измельчённой краски Судан III и метилового синего, затем добавляется 10 мл 20-25% раствора аммиака и 20 мл воды очищенной, взбалтывается. Раствор годен в течение 6 месяцев.
Эти операции проводятся каждый день на основании приказа №309 от 21.10.1997 года «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)». Результаты анализов заносятся в «Журнал регистрации анализов качества вымытой посуды»
| Дата | № Анализа | Наименование | Результат | Проверил |
| 58 | Колба 100 мл | Уд | ||
| 59 | Стакан 50 мл | Уд | ||
| 60 | Цилиндр 25 мл | Уд | ||
| 61 | Пенициллиновый флакон 10 мл | Уд |
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 4
Анализ воды очищенной.
(aquapurificata).
Н2О, Мм = 18 г/моль. ФС 42-2619-97
Химический (качественный), включая определение рН.
- вода очищенная, ежедневно (из каждого баллона) проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода предназначенная для изготовления стерильных растворов, кроме указанных выше испытаний, должна быть проверена на отсутствие восстанавливающих веществ, солей аммония и углерода диоксида.
Ежеквартально вода очищенная направляется в территориальную контрольно – аналитическую лабораторию для полного химического анализа (определяются примеси тяжёлых металлов, нитратов, нитритов).ПРИКАЗ №214.
| Что определя- ется. | Методика работы, химизм реакций, расчеты. | Результат. |
| Внешний вид. | Бесцветная, прозрачная жидкость, без запаха и вкуса.рН=5-7 | Соотв. ФС |
| Восстанавливающие вещества. H2C2O4 | 100 мл воды доводят до кипения, добавляют 1мл 0,01% моль/л р-ра перманганата калия и 2мл разведённой серной кислоты, кипятят 10мин. Pозовая окраска должна сохраниться H2C2O4 + KМnO4 + H2SO4 = MnSO4 + K2SO4 + + CO2 + H2O | Соотв. ФС |
| Диоксид углерода. CO2 | При взбалтывании воды с равным количеством известковой воды в наполненном доверху и хорошо закрытом сосуде, не должно наблюдаться помутнения в течение часа. СО2 + Са(ОН)2 = СаСО3↓ + Н2О | Соотв. ФС |
| Кальций. Ca2+ | К 10мл воды добавляют 1мл раствора NH4Cl, 1мл NH4OH и 1мл аммония оксалата. Перемешивают и оставляют на 10мин. Не должно быть помутнения. Са2+ + NH4Cl + NН4OH + (NH4)2С2О4 = СаС2О4↓ + Н2О + ClЇ | Соотв. ФС |
| Хлориды. C1Ї | К 10мл воды добавляют 0,5мл азотной кислоты и 0,5мл р-раAgNO3. Перемешивают и оставляют на 5мин. Не должно быть опалесценции. ClЇ + AgNO3 = AgCl↓(осадок) + NO3Ї | Соотв. ФС |
| Аммиак. NH4+ | К 10мл воды добавляют 0,15мл реактива НесслераK2[HgI4], перемешивают, через 5мин сравнивают с р-ром, состоящим из смеси 1мл эталонного р-ра Б, содержащего 0,002мг иона аммония в 1мл и 9мл воды, свободной от аммиака и такого же количества реактива, который прибавлен к испытуемому раствору. Окраска, появившаяся в испытуемом р-ре не должна превышать окраску эталона. NH4+ + K2[HgI4] +KOH = [(HgI)2NH2]I↓(осадок)+ + KI + H2O | Соотв. ФС |
| Сульфаты. SO42- | К 10мл воды добавляют 0,5мл HCl(р) и 1мл раствора BaCl2, перемешивают и оставляют на 10мин. Не должно быть помутнения. Сравнение ведут с раствором: 10мл испытуемого раствора вместе с реактивами, кроме основного раствора. Раствор делят на 2 части и к одной из них добавляют основной реактив и сравнивают. SО42Ї + Ва2+ ----→ВаSО4↓ | Соотв. ФС |
| Тяжелые металлы | К 10 мл воды прибавляют 1 мл кислоты уксусной разб. 2 капли Na2Sперемешивают и оставляют на 1 мин. Наблюдение окраски производят по оси пробирок диаметром ~ 1,5 см помещенных на белой поверхности. Не должно быть окрашивания. Pb2+ + Na2S ---→ PbS↓ + 2Na+ | Соотв. ФС |
| Микробиологическая чистота | Должна соответствовать требованиям на питьевую воду (не более 100 м/о на 1 мл), при отсутствии бактерий семейства энетеробактерацио, стафилококки, псевдомонносаэрогеназа. Испытания проводят в соответствии со статьей ГФ Х1. Испытание на м/б чистоту (ГФ Х1 стр. 193, 1 том). | Соотв. ФС |
Вывод: соответствует требованиям ФС
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 5
Анализ раствора калия йодида 5% - 500,0
Rp.:Sol. Kaliiiodidi 5% - 500,0
S. Для физиолечения
Возьми: Раствора калия йодида 5% - 500,0
Выдай. Обозначь. Для физиолечения.
КУ Мм=166,01 г/моль
Однокомпонентная лекарственная форма.
В соответствии с приказом МЗ РФ №214 от 16.07.1997г.
«О контроле качества лекарственных средств, изготовляемых в аптечных организациях»:
Обязательный контроль:
1. Письменный
2. Контроль при отпуске
3. Органолептический
Дополнительный контроль:
1.Опросный
2.Физический
3.Полный химический
Исследуемый раствор отпускается во флаконах оранжевого стекла, объемом 500мл, в хорошо укупоренной таре.
Общий объём 500,0мл
Sдоп=1%(п.2.5. приказа МЗ РФ №305 от 16.10.97) Следовательно, 500*1/100=5
Отклонение допустимое: 500±5 (505 — 495)
| Что определяется | Методика работы, химизм реакции, расчеты. | Результат |
| Описание: | Бесцветная, прозрачная жидкость, без запаха. | соотв. ГФ ХI |
| У Ї | К 0,5 мл раствора прибавляем 2-3 кап НCl(разб), 1мл хлорамина и 1 мл хлороформа, взбалтываем. Хлороформный слой окрашивается в фиолетовый цвет. | соотв. ГФ ХI |
| К+ | К 1-2 мл раствора прибавляем 2-3 кап СН3СООН(разб), 1-2 кап раствора натрия кобальтнитрита, 1-2 мл хлороформа, взбалтываем. Хлороформный слой окрашивается в фиолетовый цвет, в водном слое наблюдается желтый кристаллический осадок. | соотв. ГФ ХI |
Количественное определение.
Метод: рефрактометрический
Теоретическое обоснование метода: метод основан на наблюдении предельных границ преломления полного внутреннего отражения луча при переходе из одной среды в другую, отличающаяся по оптической плотности. Физическая сущность преломления связана с изменением так называемой скорости волны при переходе света из одной среды в другую.
nводы=1 ,3З3nраств.=1,3397
Методика: Измеряют показатель преломления 5% раствора при температуре 200С. Содержание калия йодида (Х) в 1мл препарата в граммах вычисляют по формуле:
Х= nводы - nраств./0,00130
Х=1 ,3397-1 ,333/0,00 130=5,15%
Где 0,00130 — фактор, равный величине прироста показателя преломления раствора калия йодида при увеличении концентрации на 1%. В 1мл раствора должно быть 0,0515 — 0,0485
Sабс=5, 15-5,0=0,15
Sотн=0,15*100%/5= 3%
В соответствии с приказом МЗ РФ №305 от 16.10.1997г.«О нормах отклонений допускаемых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организациях» п.2.7. отклонение по массе входит в норму допустимых отклонений:Sдоп =3%
Вывод: исследуемая лекарственная форма приготовлена удовлетворительно.
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 6
Приготовление растворов, реактивов, индикаторов, титрованных и эталонных растворов. Учёт расхода реактивов и отчётность.
Химическим реактивом, называется вещество, с помощью которого можно качественно обнаружить или количественно определить другое вещество. С помощью химического реактива можно установить содержание отдельных частей исследуемого вещества. Реактивы широко применяются в аптечной практике для оценки качества лекарственных средств, поэтому провизор должен ориентироваться в ассортименте реактивов, уметь расшифровать их маркировку, проверять условия хранения и правильность использования.
По области применения реактивы делятся на следующие категории:
- индикатор
- носитель для хроматографии
- фармакопейный
- специальный.
В аптеке используются индикаторы и категория фармакопейный реактив (титрованные растворы и др.).транспортирование проводится в контейнерах, при соблюдении соответствующих условий в зависимости от свойств реактивов.
Аптека выписывает требование – заказ на нитрованные растворы и реактивы. Форма требования – заказа прилагается. Требование на реактивы содержащие нитрат серебра выписывается отдельно на латинском языке, заверяется круглой печатью предприятия и подписью руководителя. Отпуск серебра нитрата производится по разовой доверенности. Реактивы и индикаторы рекомендуется выписывать, учитывая месячную потребность.
В аптеке проводится сбор отходов нитрата серебра по утвержденной методике. Отходы нитрата серебра представляют собой смесь солей серебра, образующихся при проведении анализов с использованием растворов нитрата серебра. Для полного сбора указанных отходов в аптеке все продукты реакции с использованием растворов нитрата серебра, колларгола, протаргола, сливаются в специальный сосуд. К собранным отходам добавляют хлороводородную кислоту до сильнокислой реакции, фильтруют через двойной бумажный обеззоленный фильтр, осадок на фильтре промывают водой и сушат на воздухе в темном месте. Высушенный осадок снимается с фильтра, взвешивается и переносится в специальную тару. Хранится в запирающемся шкафу. Сдачу осажденного серебра проводят 1 раз в квартал, составляется отчет:
Отчет о расходе AgNO3, за III квартал 2015г.
Отчет составляется в виде таблицы, содержит следующие графы: наименование раствора нитрата серебра, его концентрация, остаток на начало квартала, приход, расход, теоретический выход, фактически сдано 80%. Провизор аналитик сдавший шлам расписывается. Отчет заверяется печатью и подписью руководителя аптеки.
В аптеке готовятся следующие реактивы:
- раствор серной кислоты разведенной
- раствор азотной кислоты разведенной
- раствор уксусной кислоты разведенной
- раствор соляной кислоты разведенной
- известковая вода
- раствор гидроксида аммония
- раствор аммиака
- раствор хлорида аммония 10%
- раствор оксалата аммония
- аммиачно-буферный раствор
- раствор B-нафтола и др.
Индикаторы:
- тимолфталеин
- дифенилкарбазон
- нингидрин
- мурексид
- нитропруссид натрия
- феноловый красный
- бромфениловый синий
- тимоловый синий
Приготовление реактива хромата калия 5% 50 мл
K2CrO4 Mм = 194, 20 г/моль
Описание: Хромат калия представляет собой золотисто-жёлтые мелкие кристаллы хорошо растворимые в воде.
На приготовление 50мл 5% необходимо взять:
Хромата калия 5 – 100
х – 50 х = 2,5 г
Воды до 50 мл
Технология: На ручных весочках отвешивается 2,5 г хромата калия, пересыпается в мерную колбу, ёмкостью 50 мл, и доводится водой очищенной до метки, перемешивается. Переливается в склянку тёмного стекла и укупоривается. Срок хранения: 1 месяц.
Протокол №7
Приготовление реактива калия ферроцианида 5% 10 мл
(жёлтая кровяная соль)
K4{Fe(CN)6} * 3H2OMм = 422, 40 г/моль
Описание: Калияферроцианидпредставляет собой лимонно-жёлтые кристаллы хорошо растворимые в воде.
На приготовление 10мл 5% необходимо взять:
Ферроцианида калия 5 – 100
х – 10, 0,5 г
Воды до 10 мл
Технология: На ручных весочках отвешивается 0,5 г ферроцианида калия, пересыпается в мерную колбу, ёмкостью 10 мл, и доводится водой очищенной до метки, перемешивается. Переливается в склянку тёмного стекла и укупоривается. Срок хранения: 1 месяц.
Приготовление реактива хлорида аммония 10% 100 мл
NH4ClMм = 53, 50 г/моль
Описание: Аммония хлоридпредставляет собой белый кристаллический порошок хорошо растворимый в воде.
На приготовление 100мл 10% необходимо взять:
Хлорида аммония 10 – 100
х – 100, 5,0 г
Воды до 100 мл
Технология: На ручных весочках отвешивается 5,0 г хлорида аммония, пересыпается в мерную колбу, ёмкостью 100 мл, и доводится водой очищенной до метки, перемешивается. Переливается в склянку тёмного стекла и укупоривается. Срок хранения: 1 месяц.
Приготовление реактива аммония оксалата 4% 100 мл
(COONH4)2 * H2OMм= 142, 11 г/моль
Описание: Аммония оксалатпредставляет собой белые кристаллы, растворимые в горячей воде.
На приготовление 100мл 4% необходимо взять:
Хлорида аммония 4 – 100
х – 100, 4,0 г
Воды до 100 мл
Технология: На ручных весочках отвешивается 5,0 г хлорида аммония, пересыпается в термостойкую мерную посуду, ёмкостью 100 мл, растворяется при нагревании в небольшом количестве воды и доводится водой очищенной до метки, перемешивается и фильтруется. Переливается в склянку тёмного стекла и укупоривается. Срок хранения: 1 месяц.
Протокол № 8
Анализ раствора кальция хлорида 50 %-500,0
Rp.:Sol. Calciichloridi 50% - 500,0
D.S.
Возьми:Раствора кальция хлорида 50%-500,0
Выдай. Обозначь.
СаСI2*6H2O Мм=219,08
Однокомпонентная лекарственная форма.
В соответствии с приказом МЗ РФ №214 от 16.07.1997г.
«О контроле качества лекарственных средств, изготовляемых в аптечных организациях».
Обязательный контроль:
1. Письменный
2. Органолептический
3. Полный химический.
Дополнительный контроль:
1. Опросный
2. Физический
Исследуемый раствор хранится в хорошо укупоренной таре. Общий объём 500,0мл срок годности концентрата 1 мес.
В соответствии с приказом МЗ РФ №З05 от 16.10.1997г.
«О нормах отклонений допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организапиях» п.2.5.Sдоп=1% следовательно: 500*1/100=5
Допустимое отклонение по объему: 500±5 (505 — 495)
| Что определя- Ется. | Методика работы, химизм реакций, расчеты. | Результат. |
| Описание. | Прозрачная бесцветная жидкость. | соотв. ГФ ХI |
| Подлин-ность. Са2+ | К 0,5мл р-ра добавляют 3-5кап р-ра оксалата аммония и наблюдают выпадение осадка белого цвета. Реакцию проводим в присутствии уксусной к-ты, так как осадок растворим в минеральных к-тах. CaС12 +(NH4)2C2O4 = CaС2О4↓+ NH4С1 | соотв. ГФ ХI |
| С1¯ | К 0,5мл р-ра добавляют несколько кап AgNO3, образуется белый осадок, растворимый в р-ре аммиака при его добавлении. СaCl2 + 2AgNO3 = Сa(NO3)2 + 2AgCl↓ | соотв. ГФ ХI |
|
| ||
Количественное определение.
Метод: рефрактометрический
Теоретическое обоснование метода: метод основан на наблюдении предельных границ преломления полного внутреннего отражения луча при переходе из одной среды в другую, отличающаяся по оптической плотности. Физическая сущность преломления связана с изменением так называемой скорости волны при переходе света из одной среды в другую.
Методика: На призму рефрактометра наносят несколько капель воды очищенной и измеряют показатель преломления. Тщательно протирают призму и наносят на нее несколько капель исследуемого раствора и измеряют показатель преломления следующим образом. Макровинтом устанавливают четкую границу света и тени в объективе затем вторым. По шкале делений определяют показатель преломления.
Расчеты.
n0=1,333
n1=1,3873
F=0,001 08
С=n1- n0/F =1 ,3873- 1,333/0,00108=50,277%
Sабс=Mф – А = 50,277-50,0=0,277
Sотн =Sабс*100%/А=0,277* 100 %/50,0=0,554%
В соответствии с приказом МЗ РФ №305 от 16.10.1997г. «О нормах отклонений допускаемых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организациях» п.2.11. отклонение по массе входит в норму допустимых отклонений:Sдоп=1%
Вывод: исследуемая лекарственная форма приготовлена удовлетворительно.
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 9
Анализ раствора перекиси водорода3%-100,0 №100
Rp.: Sol. Hydrogeniiperoxydidiluti 3% - 100ml
D.S.
Возьми: Раствора перекиси водорода 3% - 100 мл.
Выдай.Обозначь.
Состав: Раствор перекиси водорода 44%-6,82 мл
Натрия бензоата 0,05
Воды очищенной. 93,18 мл
Hydrogeniiperoxydum
H2O2Мм = 34 г/моль
Natriibensoas
Мм = 144г/моль
AguapurificataH2OМм = 18г/моль
В соответствии с приказом МЗ РФ №214 от 1б.07.1997г.
«О контроле качества лекарственных средств, изготовляемых в аптечных организациях»:
Обязательный контроль:
1. Письменный
2. Контроль при отпуске
З. Органолептический
Дополнительный контроль:
1. Опросный
2. Физический
3. Полный химический.
Исследуемый раствор хранится в хорошо укупоренной таре из темного стекла. Общий объём 100,0мл
В соответствии с приказом МЗ РФ №З05 от 16.10.1997г.
«О нормах отклонений допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организапиях» п.2.5.Sдоп=3% следовательно: 100*3/100=3
Допустимое отклонение по объему: 100±3 (97 — 103)
| Что определяется | Методика работы, химизм реакции | результат |
| Описание: | Бесцветная, прозрачная жидкость, со специфическим запахом. | соотв. ГФ ХI |
| Перекись водорода | К 0,5 мл раствора прибавляем 0,2 мл разведенной серной кислоты и 2 мл эфира, 0,2 мл бихромата калия и взбалтываем. Эфирный слой окрашивается в синий цвет. | соотв. ГФ ХI |
| Натрия бензоат | 30 мл раствора упаривают до остаточного количества 2 мл добавляют 2мл 5 моль/л раствора сульфата меди.Образуется осадок буро – зеленого цвета. | соотв. ГФ ХI |
Количественное определение.
Метод: пермангонатометрия
Способ: прямое титрование
Индикатор: безиндикаторный
Среда: серная кислота разбавленная
Теоретическое обоснование: метод основан на реакции ОВР
Химизм:
Методика: К 1 мл препарата прибавляем 9 мл воды . Во флакон вносим 1 мл препарата и 5 мл разведенной серной кислоты. Титруем 0,1 моль/л раствором пермангоната калия до появления слабо – розовой окраски. Окраска не должна исчезать в течение 5 минут.
Расчеты:
T= Mm(в-ва) * С(титранта)*f/ 1000 = 34*0,1*0,5/1000*= 0,0017 г/мл
V(np) = m(HAB) * %(B-BA)*Vп/ T * 100%*Vк=1*3*1/ 0,0017*100*10 = 1,76
Vф = 1,75
mф=V(титранта) * T * V(общ)*Vк /m(HAB)*Vп =1,75*0,0017*100/1= 2,9г
Sабс= Mф – А = 2,9 – 3 = 0,1
Sотн= Sабс *100%/А = 0,1*100/3= 3,33%
В соответствии с приказом МЗ РФ №305 от 16.10.1997г. «О нормах отклонений допускаемых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организациях» п.2.7. отклонение по массе входит в норму допускаемых отклонений:Sдоп=±4%
Вывод: Исследуемая лекарственная форма приготовлена удовлетворительно.
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 10
Анализ раствора эуфиллина 2%-100 мл
Rр: Sol. Euphyllini 2%-100 ml
S. Для электрофореза.
Возьми: Раствора эуфиллина 2%-100,0
Обозначь. Для электрофореза.
Теофиллин Мм = 180,17
1,2-этилендиамин Мм = 60,1
Теофиллин с 1,2-этилендиамином Мм=240,27 г/моль.
Однокомпонентная лекарственная форма.
В соответствии с приказом МЗ РФ №214 от 16.07.97 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях»:
Обязательный контроль:
1.Письменный
2.Контроль при отпуске
3.Органолептический
Дополнительный контроль:
1.Опросный
2.Физический
3.Полный химический
Раствор отпускается во флаконах темного стекла по 100 мл.укупоренных полиэтиленовым колпачком и пластмассовой навинчивающейся крышкой.
Общий объём равен 100 мл. Sдоп=3% (п.2.5.приказа МЗ РФ №305 от 16.10.1997г.) следовательно, 100*3/100=3
Отклонение: 100±3(103-97)мл.
| Что определяется | Методика работы, химизм реакции, расчеты. | Результат |
| Описание: | Бесцветная, прозрачная жидкость, со слабым аммиачным запахом. | соотв. ГФ ХI |
| Подлинность 1,2-этилендиамин | К 1-2 мл раствора добавляем 1-2 капли раствора сульфата меди.Появляется фиолетовое окрашивание. | соотв. ГФ ХI |
| Теофиллин | 1-2 мл р-рапомещают в фарфоровую чашку добавляют по 10кап HCl(p) и пергидроля и нагревают на водяной бане. После охлаждения к сухому остатку добавляют 3-5кап аммиака. Обнаруживают пурпурно-красное окрашивание.
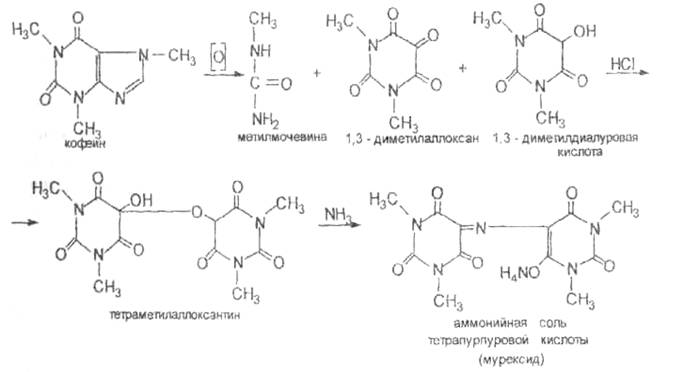
| соотв. ГФ ХI |
Количественное определение.
Метод: ацидиметрический
Способ: прямое титрование
Индикатор: метиловый оранжевый
Среда: нейтральная
Теоретическое обоснование метода: метод основан на реакции нейтрализации.
Химизм реакции:
Методика: К 0,5мл прибавляем несколько капель индикатора метилового оранжевого и титруем 0,1 моль/л раствором кислоты хлористоводородной до розового окрашивания.
Расчеты:
T(НС1/ЭДА)=М(эда)*С(НС1)* f/1000=60,1*0,1*0,5/1000=0,003005
T(пересчетный) = T(НС1/ЭДА) *100% / 20,6% = 0,003005*100%/20,6% =0,0145
Vпр.=m(HAB) * %(B-BA) / T(пересчетный) * 100% =0,5*2%/0,0145*100% =0,69мл
Vф.= 0,71мл
mф=V(титранта) * T * V(общ)/m(HAB)=0,71*0,0145*100/0,5=2,059
Sабс= Mф – А = 2,059-2,0=0,059
Sотн=Sабс*100%/А=0,059* 100/2=2,95%
В соответствии с приказом МЗ РФ №305 от 16.10.1997г. «О нормах отклонений допускаемых при изготовлении лекарственных средств и фасовке промышленной продукции в аптечных организациях» п.2.7. отклонение по массе входит в норму допускаемых отклонений:Sдоп=5%
Вывод: исследуемая лекарственная форма приготовлена удовлетворительно.
Дата:
Подпись студента:
Подпись руководителя:
Протокол № 11
Дата добавления: 2018-06-01; просмотров: 3417; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
