Опыт 6. Взаимодействие оксидов фосфора с водой. Получение раствора ортофосфорной кислоты
Обмыть стеклянную воронку и стенки стакана (опыт 3) дистиллированной водой. Добавить индикатор – метиловый оранжевый:
- охарактеризовать растворимость оксидов фосфора
- составить уравнения реакции оксидов фосфора с водой:
P2O5 + H2O →…
P2O3 + H2O →…
- объяснить изменение окраски индикатора в растворе и среда в полученном растворе…………..
- составить уравнения электролитической диссоциации ортофосфорной кислоты:
1 стадия: H3PO4 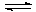 …
…
2 стадия: H2PO4- 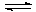 …
…
3 стадия: HPO42- 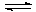 …
…
- составить выражения для констант диссоциации (К1; К2; К3), привести значения констант
К1 = К2 = К3 =
- в каком направлении смещены равновесия диссоциации первой, второй и третьей стадии;
- какая стадия диссоциации осуществляется лучше
- назвать все полученные соединения и ионы, содержащие фосфор
- охарактеризовать кислотно-основные свойства оксидов фосфора и ортофосфорной кислоты.
Опыт 7. Гидролиз солей ортофосфорной кислоты
На предметное стекло поместить три кусочка универсальной индикаторной бумаги и нанести на них по 1 капле растворов солей: ортофосфата натрия, гидрофосфата натрия и дигидрофосфата натрия. Определить pH – растворов солей, сравнив окраску индикаторной бумаги со шкалой.
- Записать уравнения процессов, протекающих в растворах указанных солей в молекулярной и ионной форме
|
|
|
Na3PO4 + H2O →…
Na2HPO4 + H2O →…
NaH2PO4 + H2O →…
- Рассчитать константы гидролиза и сравнить их с константами диссоциации
Кгидр(PO43-) =
Кгидр(НPO42-) = Кдисс(НPO42-) =
Кгидр(Н2PO4-) = Кдисс(Н2PO4-) =
- Объяснить, почему растворы имеют разную кислотность
Опыт 8.Осаждение фосфатов железа (III) и алюминия
В две пробирки внести по 3-4 капли растворов солей: в первую – хлорида железа (III), во вторую – хлорида или сульфата алюминия. Добавить в каждую пробирку по 2-3 капли растворов ацетата натрия и гидрофосфата натрия Na2HPO4 .
- Отметить цвета выпавших осадков.
- Написать уравнения реакций, учитывая, что в присутствии ацетата натрия образуются средние соли: фосфат железа (III) и фосфат алюминия, нерастворимые в уксусной кислоте.
FeCl3 + Na2HPO4 + CH3COONa →…
AlCl3 + Na2HPO4 + CH3COONa →…
- Вывод
Реакции обнаружения анионов
9.1. Нитрат-ион NO3-
Реакция с солью Мора
На предметное стекло насыпать горкой сухой соли Мора (NH4)2SO4хFeSO4. С одной стороны этой горки налить 1 каплю концентрированной серной кислоты, а с другой - исследуемый раствор. В середине появляется тёмное пятно:
|
|
|
6Fe2+ + 2NO3- + 8H+ ® 6Fe3+ + 2NO + 4H2O
NO + Fe2+ + SO42- ® [Fe(NO)SO4]
Реакции мешают иодид-ионы, поэтому их сначала удаляют.
Реакция с дифениламином. Если отсутствует иодид-ион I-, то к 2 каплям исследуемого раствора прилить 2 капли дифениламина. Если наблюдается посинение раствора, то нитрат-ион присутствует.
9.2 Фосфат-ион РО43-
Открывается реакцией с молибденовой жидкостью. К 1-2 каплям исследуемого раствора прилить 8-10 капель молибденовой жидкости (раствор (NH4)2MoO4 в HNO3), нагреть в водяной бане. Через некоторое время выпадает кристаллический осадок фосфоромолибдата аммония:
PO43- + 3NH4+ + 12 MоO42- + 24H+ ® (NH4)3[PMо12O40]¯ + 12H2O
Осадок выпадает только при большом избытке молибденовой жидкости. Мешают реакции ионы-восстановители: S2- , Cl-.
Дата добавления: 2018-05-31; просмотров: 461; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
