Свойства и применение полистирола
Полистирол – это твёрдый аморфный продукт: плотность 1050-1060кг/м3; молярная масса и плотность полистирола зависят от способа производства; молярная масса 30000-300000кг/моль. Молярная масса полистирола, полученного эмульсионным способом может быть больше 300000кг/моль. Полистирол – хороший диэлектрик, его свойства не зависят от влажности практически не изменяются в пределах температур от -800С до +900С. Блочный полистирол прозрачен и бесцветен.
Недостатки полистирола: низкая теплостойкость, низкая ударная прочность, склонность к старению, при нагревании до 300-4000С полистирол деполимеризуется с образованием мономеров.
Достоинства: полистирол легко перерабатывается товарами народного потребления; основной метод переработки – литье под давлением.
Из полистирола получают: плёнку стирофлекс, она обладает большой прочностью и высокими диэлектрическими показателями. Стирофлекс – наиболее часто применяют для конденсаторов. Другие виды полистирола используют для электроизоляционных и антикоррозионных целей: полистирольные лаки и т.д.
Эмульсионный полистирол используют для получения пенополистирола. Для улучшения свойств полистиролов в него вводят различные накопители: мраморная пыль, кварцевая мука, тальк и др.
Введением в полистирол пластификаторов (диактилфтолат, трифинилфосфат) добиваются улучшения пластинчатых свойств. В промышленности широко используются различные сополимеры стирола марок УПС, ударопрочность полистирола имеет высокую ударную прочность, используют как АБС пластика. Полимеры, как таковые редко используются для изготовления готовых изделий, в основном они являются сырьём для получения пластических масс.
|
|
|
Производство аммиака
В природе источников связанного азота очень мало. Между тем, потребность народного хозяйства в азотосодержащих продуктах очень велика. Из NH3 получают различные виды минеральных удобрений, HNO3 (до 35% NH3 идёт на её производство), различные красители, взрывчатые вещества; NH3 добавляют в различные пластмассы, а также в различные химические волокна, хладагенты.
Способы связывания атмосферного азота
циано аммиачный
СаС2 + N2 ® CaCN2 + C + 301,5 кДж N2 + 3H2 « 2NH3 + Q
Азот из воздуха получают электробытовым методом.
Аммиак – газ с резким запахом, температура кипения -330С, температура плавления -780С, предельно-допустимая концентрация – 20мг/м3. Хорошо растворим в воде, в 1 л воды растворяется 700 л NH3 при 200С и атмосферном давлении.
|
|
|
Сухой NH3 образует с воздухом взрывоопасную смесь в пределах концентраций 15,5-27% объёма. Синтез NH3 проводят аммиачным способом. Соотношение N2 : H2 = 1 : 3. В настоящее время для синтеза NH3 используют N-Н-смесь, полученную из С - содержащих газов атмосферного воздуха. Основным сырьём является природный газ, содержащий 90-98% СН4.
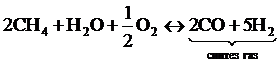
В воздухе содержание азота доводят до 70% объёма, в результате химической реакции образуется синтез-газ и чистый азот. Процесс идёт таким образом, чтобы в конечной газовой смеси отношение между образующимися N2 и Н2 было 1 : 3.
В углеродном газе содержатся различные соединения серы. После конверсии СН4 в газе содержатся СО2, СО. Для очистки азото - водородной смеси используются органические основания (НОСН2 – NH2; К2СО3). После абсорбции конвективный газ содержит около 0,4% об. СО, СО2, СН4, О2. Для удаления кислород – содержащих соединений используют методы каталитического гидрирования, промывку газа жидким азотом или медноаамиачную промывку под давлением.
1. Каталитическое гидрирование
Катализаторы: Ni, Pt, Pd, Fe
CO + 3H2 « H2O + CH4
CO2 + 4H2 « 2 H2O + CH4
O2 + 2H2 « 2H2O
2. Медно-аммиачная очистка
СО абсорбируется раствором с образованием медно-аммиачного комплекса. Абсорбционная способность в обычных условиях невелика, но с повышением давления она увеличивается. Для данного процесса характерны низкие температуры. Для очистки азото – водородной смеси применяют давление 10-30МПа и температуру 0 – 250С. Используют обычно медно-аммиачные растворы слабых кислот. Регенерацию проводят при атмосферном давлении и температуре 800С. После очистки в газе остаётся не более 0,003% СО.
|
|
|
3. Промывка жидким азотом
При этом происходит очистка от СО, H2S, CH4 и др. Эти примеси имеют более высокую температуру кипения и поэтому конденсируются в жидком азоте. Обычно в промывной колонне поддерживают такую температуру, чтобы одновременно с конденсацией происходило донасыщение азото – водородной смеси до соотношения 1 : 3.
Процесс синтеза NH3 обратимый и идёт с понижением объёма продуктов реакции. Процесс идёт с выделением тепла, поэтому по принципу Ле-Шателье, чтобы сместить равновесие в сторону продуктов реакции, надо повысить давление и понизить температуру.
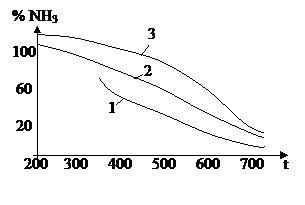 |
1 – при р = 10 МПа
2 – при р = 30 МПа
3 – при р = 100 МПа
При низких температурах синтез NH3 протекает очень медленно, поэтому процесс ведут при температуре более 4000С. В промышленности применяют катализатор FeO с активаторами Al2O3, CaO, SiO2, получают сплавлением.
|
|
|
Примерный состав катализатора для синтеза NH3, %: FeO – 32% CaO – 2,5%
Fe2O3 – 62% SiO2 – 0,24%
Al2O3 – 1,7% CrO – 1,6%
Восстановление катализатора проводят водородной смесью, в результате чего оксида Fe восстанавливается до металлического Fe.
Сырьё, применяемое в производстве и получаемые продукты.
Расходные коэффициенты на 1 т аммиака
- природный газ 860 м3
- электроэнергия 1250 кВт/час
- вода 300 м3
- пар 1 т
- катализатор:
- конверсии метана
- 0,4 кг
- аммиака 0,08 кг
Дата добавления: 2018-06-27; просмотров: 374; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
