ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Министерство образования и науки Российской Федерации
федеральное государственное бюджетное образовательное учреждение высшего образования
«Санкт-Петербургский государственный университет промышленных технологий и дизайна»
«Высшая школа технологии и энергетики»
Преподаватель
«___»_ 20.......
..………………………….....
.
Х И М И Я
Ж у р н а л л а б о р а т о р н ы х р а б о т
Студент ……………………………………………………………………….
Факультет………………………………………………………………………
Специальность………………………………………………………………….
Шифр………………………………………………………………………………
Санкт-Петербург …................
Лабораторная работа 1.
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Цель работы: Ознакомление с кинетическими закономерностями протекания химических реакций, с особенностями обратимых химических взаимодействий; экспериментальное изучение влияния различных факторов на скоростьреакции и направление смещения химического равновесия.
Опыт 1. Изучение влияния концентрации реагентов на скорость химической реакции
Уравнениеизучаемойреакции:
2KIO3+ 5Na2SO3+ H2SO4→I2↓+ 5Na2SO4+ K2SO4+ H2O
НАБЛЮДЕНИЯза ходом протекания реакции:
Во время сливания растворов в течение некоторого времени реакция идёт без изменения цвета, спустя некоторое определённое время цвет раствора меняется до тёмно-синего.
Данная химическая реакция относится к разрядугомогенных реакций.
Таблица экспериментальных данных и рассчитанных величин
| Номер раствора | Время, τ(с) | Относительная
скорость реакции,
Vотносит. =  (с-1 ) (с-1 )
| Относительная концентрация, Сотн. |
| 1 | 12 | 0,083 | 0,6 |
| 2 | 15 | 0,066 | 0,5 |
| 3 | 18 | 0,055 | 0,4 |
| 4 | 21 | 0,047 | 0,3 |
| 5 | 30 | 0,033 | 0,2 |
График зависимости относительной скорости реакции
От относительной концентрации реагента

Математический характер зависимости относительной скорости реакции от относительной концентрации реагента Na2SO3: кривая имеет схожесть с прямой y=bx +c
Порядок реакции по данному реагенту Na2SO3 приблизительно равна 1.
В Ы В О Д
В данной лабораторной работе были изучены кинетические закономерности протекания химических реакций и особенности обратимых химических взаимодействий; Также было освоено экспериментальное изучение влияния различных факторов на скоростьреакции и направление смещения химического равновесия. Так, было исследовано, что реакция взаимодействия сульфита натрия с йодатом калия протекает протекает по первому порядку (по Na2SO3)
Опыт 2. Изучение влияния концентраций на положение химического равновесия в системе
FeCl3 + 3 NH4NCS⇄Fe(NCS)3 + 3 NH4Cl
Предварительные исследования:
Цвет раствора FeCl3- жёлтый
Цвет раствора NH4NCS- бесцветный
Цвет реакционной смеси (FeCl3 + NH4NCS)–между вишнёво-красным и коричнево-жёлтым
.
Таблица экспериментальных данных
| № п/п | Добавляемый компонент системы (формула) | Изменение интенсивности окраски (ослабление, усиление) | Направление смещения равновесия (влево, вправо) |
| 1 | FeCl3 | Усиление окраски | вправо |
| 2 | NH4NCS | Усиление | вправо |
| 3 | NH4Cl | Ослабление | влево |
Объяснения наблюдаемых явлений с помощью принципа Ле Шателье:
Увеличение концентрации исходных реагентов смещает равновесие в сторону образования продуктов реакции, и наоборот: увеличение концентрации продуктов реакции смещает равновесие в сторону исходных реагентов.
Выражение для константы равновесия:
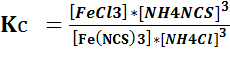

В Ы В О Д
В данном эксперименте было изучено влияние концентраций на положение химического равновесия в системе:
FeCl3 + 3 NH4NCS ⇄ Fe(NCS)3 + 3 NH4Cl.
А также экспериментально подтвержден принцип Ле Шателье.
Работу выполнил:……………………………………………(подпись студента)
Работу принял…………………………………………(подпись преподавателя)
Дата………………………………………………………………………………….
Лабораторная работа 2.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Цель работы:Исследование свойств растворов сильных и слабых электролитов. Изучение реакций в растворах электролитов и приобретение навыков составления уравнений этих реакций в молекулярном и ионно-молекулярном виде.
Опыт 1. Окраска индикаторов
Изучаемые кислотно-основные индикаторы:
· фенолфталеин
· лакмус
· метиловый оранжевый.
Для создания нейтральной среды использованавода (H2O).
Для создания кислой среды использован раствор серной кислоты (H2SO4).
Для создания щелочной среды использован раствор гидроксида натрия (NaOH).
Таблица экспериментальных данных
| Среда | Окраска индикатора | ||
| Лакмус | Метиловый оранжевый | Фенолфталеин | |
| Нейтральная | фиолетовый | оранжевый | бесцветный |
| Кислая | красный | Розовый | бесцветный |
| Щелочная | синий | жёлтый | малиновый |
В Ы В О Д
Индикаторыметиловый оранжевый и лакмусявляются индикатором универсального действия, т.к. изменяют окраску в каждой из изученных сред. Индикатор фенолфталеинявляется индикатором избирательного действия, т.к. изменяет окраску только в щелочнойсреде.
Опыт 2. Обменное взаимодействие между NiSO4 и NaOH.
НАБЛЮДНИЯ:Смешав растворы сульфата никеля (NiSO4) и гидроксида натрия (NaOH) выделился нерастворимый осадок бледно-салатового цвета.
Молекулярное уравнение реакции: NiSO4 + 2NaOH→Ni(OH)2↓ + Na2SO4
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществамиявляются:гидроксид никеля(II) (Ni(OH)2)
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являютсягидроксид натрия (NaOH), сульфат натрия (Na2SO4) и сульфат никеля (II)(NiSO4).
При составлении ионно-молекулярного уравнения их формулы следует записать в ионнойформе.
Среди участников реакции слабыми электролитами являютсягидроксид никеля(II) (Ni(OH)2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Полное ионно-молекулярное уравнение реакции:
Ni2+ + SO42- + 2Na+ + 2OH- → Ni(OH)2↓ + 2Na+ + SO42-
Краткое ионно-молекулярное уравнение реакции:
Ni2+ + 2OH- → Ni(OH)2↓
В Ы В О Д
В данном эксперименте была изучена реакция сульфата никеля (II) и гидроксида натрия, в результате которой произошло образование труднорастворимого продукта Ni(OH)2 бледно-салатового цвета.
Опыт 3. Обменное взаимодействие между сульфатом меди (II)(CuSO4) и гидроксидом натрия (NaOH).
НАБЛЮДЕНИЯ:Раствор голубого цвета (CuSO4) сливаем с бесцветным раствором гидроксида натрия (NaOH). Выпал тёмно-синий осадок.
Молекулярное уравнение реакции: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются:гидроксид меди (II)(Cu(OH)2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являютсягидроксид натрия(NaOH), сульфат натрия(Na2SO4) и сульфат меди(II)(CuSO4).
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являютсягидроксид меди (II)(Cu(OH)2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Полное ионно-молекулярное уравнение реакции:
Cu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2↓ + Na+ + SO42-
Краткое ионно-молекулярное уравнение реакции:
Cu2+ + 2OH- → Cu(OH)2↓
В Ы В О Д
(о направленности протекания данной реакции)
В данном эксперименте была изучена реакция сульфата меди (II) и гидроксида натрия, в результате которой произошло образование труднорастворимого продукта Cu(OH)2 тёмно-синего цвета.
Реакция направлена в сторону образования труднорастворимого осадка Cu(OH)2 .
Опыт 4. Обменное взаимодействие между хроматом калия (K2CrO4) и хлоридом бария (BaCl2).
НАБЛЮДЕНИЯ:Смешали прозрачный раствор жёлтого цвета (K2CrO4) с бесцветным раствором (BaCl2). Смешанный раствор помутнел, дав жёлтый осадок.
Молекулярное уравнение реакции: K2CrO4 +BaCl2 → BaCrO4↓ + 2KCl
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются:хромат бария (BaCrO4).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являютсяхромат калия (K2CrO4), хлорид бария (BaCl2) и хлорид калия (KCl).
При составлении ионно-молекулярного уравнения их формулы следует записать в ионнойформе.
Среди участников реакции слабыми электролитами являютсяхромат бария (BaCrO4).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Полное ионно-молекулярное уравнение реакции:
2K+ + CrO42-+Ba2+ + 2Cl-→ BaCrO4↓ + 2K+ + 2Cl-
Краткое ионно-молекулярное уравнение реакции:
CrO42-+Ba2+ → BaCrO4↓
В Ы В О Д
(о направленности протекания данной реакции)
В данном эксперименте была изучена реакция хромата калия и хлорида бария, в результате которой произошло образование труднорастворимого продукта BaCrO4 жёлтого цвета.
Реакция направлена в сторону образования труднорастворимого осадка BaCrO4.
Опыт 5. Обменное взаимодействие между нитратом ртути(II) (Hg(NO3)2) и йодидом калия (KI).
НАБЛЮДЕНИЯ: смешиваем два прозрачных раствора нитрата ртути (II) и йодида калия, реакция идёт с выпадением ярко оранжевого осадка.
Молекулярное уравнение реакции: Hg(NO3)2 + 2KI → HgI2↓ + 2KNO3
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются:йодид ртути (II) (HgI2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являются: нитрат ртути (II) (Hg(NO3)2), нитрат калия (KNO3) и йодид калия (KI).
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являются: йодид ртути (II) (HgI2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Полное ионно-молекулярное уравнение реакции:
Hg2+ + 2NO3- + 2K+ + 2I- → HgI2↓ + 2K+ + NO3-
Краткое ионно-молекулярное уравнение реакции:
Hg2+ + 2I- → HgI2↓
В Ы В О Д
(о направленности протекания данной реакции)
В данном эксперименте была изучена реакция йодида калия и нитрата ртути (II), в результате которой произошло образование труднорастворимого продукта HgI2 ярко оранжевого цвета.
Реакция направлена в сторону образования труднорастворимого осадка HgI2.
Опыт 6. Обменное взаимодействие между йодидом калия (KI) и нитратом свинца (II) (Pb(NO3)2)
НАБЛЮДЕНИЯ: смешиваем два прозрачных раствора нитрата свинца (II) и йодида калия, реакция идёт с выпадением ярко жёлтого осадка.
Молекулярное уравнение реакции: 2KI + Pb(NO3)2 → PbI2↓ + 2KNO3
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются:йодид свинца (II) (PbI2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являютсяйодид калия (KI), нитрат свинца (II) (Pb(NO3)2) и нитрат калия (KNO3)
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являютсяйодид свинца (II) (PbI2).
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Полное ионно-молекулярное уравнение реакции:
2K+ + 2I- + Pb2+ + 2NO3- → PbI2↓ + 2K+ + 2NO3-.
Краткое ионно-молекулярное уравнение реакции:
2I- + Pb2+ → PbI2↓.
В Ы В О Д
(о направленности протекания данной реакции)
В данном эксперименте была изучена реакция йодида калия и нитрата свинца (II), в результате которой произошло образование труднорастворимого продукта PbI2 ярко жёлтого цвета.
Реакция направлена в сторону образования труднорастворимого осадка HgI2.
Работу выполнил:……………………………………………(подпись студента)
Работу принял…………………………………………(подпись преподавателя)
Дата………………………………………………………………………………….
Лабораторная работа 3.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы
Приобретение навыков составления уравнений окислительно-восстановительных реакций; ознакомление с особенностями протекания окислительно-восстановительных реакций и их классификацией.
Дата добавления: 2018-06-27; просмотров: 1478; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
