LE TRAVAIL LABORATOIRE 2 «LA BIOCHIMIE DES ENZYMES»
Buts et objectifs: apprendre les méthodes de la détermination de l’activité des enzymes, l’influence des activateurs et des inhibiteurssur leur activité, déterminer expérimentalement l’activité d’α-amylase de la salive.
L’étudiant doit:
- savoir: les règles de la technique de sécurité du travail dans le laboratoire de la chimie biologique; la composition des enzymes, les idées modernes sur le mécanisme de l’action des enzymes, la classification des enzymes, leurs propriétés essentielles; la détermination de l’activité des enzymes, les unités de sa mesure; les mécanismes de l’influence des activateurs et des inhibiteurssur leur activité, l’utilisation de la détermination de l’activité des enzymes dans le diagnostic clinique;
- savoir : déterminer les enzymes dans les objets biologiques; faire l’expérience sur l’étude de l’influence des activateurs et des inhibiteurssur l’activité des enzymes; réaliser la détermination de l’activité des enzymes selon la méthode de la dilution;
- posséder: la technique des travaux laboratoires dans le laboratoire de la chimie biologique; les méthodes de l’accumulation et de l’analyse des données expérimentales.
Les enzymes sont des substances qui ont généralement la nature protéique et qui se caractérisent par l’activité catalytique. Les enzymes accélèrent les réactions passées dans l’organisme à cause de l’abaissement de la barrière énergétique des réactifs. La distinction principale des enzymes des catalyseurs de la nature non biologique consiste à haute activité catalytique et à la spécificité de l’action bien exprimée.
Le centre actif de l’enzyme est une combinaison unique des résidus d’ acides aminés qui assure la liaison directe du centre actif avec la molécule de substrat et la participation directe dans la catalyse.
Il y a des enzymes simples: la pepsine, la trypsine etc. La plupart des enzymes naturelles font partie de la classe des protéines complexes. Les composants non protéiques sont des cofacteurs qui peuvent avoir une nature chimique différente et qui se distinguent par la satbilité des liaisons avec la chaîne polypeptidique.
|
|
|
La classification des enzymesest basée sur le type de réaction chimique catalysée. Selon cela toutes les enzymes se subdivisent en 6 classes:
1. Oxydoréductases.
2. Transférases.
3. Hydrolases.
4. Lyases.
5. Isomérases.
6. Ligases.
La température qui correspond à la vitesse maximale de la réaction enzymatique s’appelle optimale (Тopt). Pour la plupart des enzymes de l’organisme humain elle est égale à
37-40 °С. En cas de l’abaissement de la température la vitesse de la catalyse enzymatique diminue, elle atteint la valeur minimale lors de la température 0 °С. Les enzymes sont thermolabiles, c’est-à-dire elles sont sensibles à haute température. La plupart des enzymes se décomposent lors de l’échauffement jusqu’à 60-70 °С pendant 1 heure ou jusqu’à 80-100 °С pendant quelques minutes à cause de la dénaturation.
Chaque enzyme a une valeur définie de рН du milieu, lors de cette valeur l’enzyme est le plus active (optimum рН). Lors de l’augmentation ou lors de la diminution de l’acidité du milieu l’activité des enzymes diminue. Comme les autres protéines les enzymes contiennent les acides aminés avec les groupes ionogènes dans les radicaux, leur degré de dissociation dépend du рН. Le changement du degré de dissociation de ces groupes influence sur la conformation de l’enzyme et sur ses propriétés catalytiques.
La spécificité des enzymes est la capacité de catalyser la transformation chimique bien définie d’un substrat ou d’un groupe de substrats analogues d’après leur composition. La cause essentielle de la spécificité est la complémentarité de la structure du centre actif de l’enzyme et du substrat. La spécificité absolue est la capacité de l’enzyme de catalyser une seule réaction. La spécificité relative (de groupe) est la capacité de l’enzyme de catalyser la transformation des substances qui ont des particularités structurales communes.
|
|
|
Les composés chimiques qui accélèrent la vitesse de la réaction enzymatique s’appellent les activateurs. Souvent les activateurs des enzymes sont représentés par Mg2+, Mn2+, Zn2+, K+ и Со2+.
Les inhibiteurs inhibent l’action des enzymes. N’importe quel agent qui provoque la dénaturation de la protéine contribue à l’inactivation irréversible de l’enzyme. Les inhibiteurs spécifiques influencent sur quelque enzyme ou sur le groupe d’enzymes.
L’inhibition réversible de l’action des enzymes peut être compétitive et non compétitive. L’inhibition compétitive est basée sur la liaison des substances qui ont la structure pareille à celle du substrat, le centre actif assure cette liaison. En ce cas le degré de l’inhibition dépend de la relation des concentrations de substrat et d’inhibiteur. La méthode de l’inhibition compétitive est souvent utilisée en pratique médicalee (les médicaments sulfamidés).
Lors de l’inhibition non compétitive le substrat et l’inhibiteur sont liés avec de différents centres. Cela provoque le changement de la conformation du centre actif et la diminution de l’activité de l’enzyme.
Pour apprécier la vitesse de la réaction enzymatique on analyse soit la vitesse de la diminution du substrat soit la vitesse de la formation des produits de réaction. Lors des conditions optimales la vitesse de la réaction catalysée est proportionnelle à la concentration de l’enzyme.
Pour apprécier l’activité de l’enzyme on utilise les unités internationales standards (Е ou U). Pour l’unité d’activité de l’enzyme 1 U(Е) on prend sa quntité qui dans les conditions optimales catalyse la transformation de 1 micromol de substrat ou la formation de 1 micromol de produit par 1 minute (mcmol/min).
|
|
|
Dans le système international des unités (SI) l’activité d’enzyme est mesurée en katals (kat): 1 kat est une activité catalytique qui est capable de réaliser la réaction avec la vitesse 1 mol/s.
1 U(Е) de l’enzyme est égal à 16,67 nkat.
L’activité spécifique de l’enzyme s’exprime par le nombre d’unités de l’activité enzymatique sur 1 mg de protéine (ou par le nombre de katals sur 1 kg de protéine active).
La plupart des enzymes sont localisées dans les tissus et dans les organes et leur activité dans le sérum du sang est insignifiante. Les processus pathologiques liés aux troubles de l’intégrité des cellules contribuent à la sortie des enzymes dans le sang. L’augmentation de l’activité des enzymes du sérum du sang est un test diagnostique qui témoigne de la pathologie des organes et des tissus définis. La détermination quntitative de l’activité d’enzymes est utilisée dans la clinique pour le diagnostic et pour l’observation de l’efficacité du traitement et du pronostic.
Les réactifs et l’équipement: la salive; les solutions d’amidon 0,1 et 0,5 %; la solution de clorure de sodium1 % ; la solution de sulfate de cuivre 1 %; la solution de Lugol; l’eau distillée; les éprouvettes; le bain thermostaté; les pipettes; les cylindres à mesurer.
1. L’action des activateurs et des inhibiteurs sur l’α-amylase de la salive.
Dans la première éprouvette on verse 1 ml de solution de chlorure de sodium 1 %, dans la deuxième on verse la solution de sulfate de cuivre 1 %, dans la troisième - 1 ml d’eau distillée. Dans toutes les éprouvettes on ajoute 2 ml de solution d’amidon 0,5 % et 2 gouttes de la salive dissous dans l’eau (1:5). On mélange le contenu des éprouvette en les secouant, ensuite on les place dans le thermostat à liquide lors de la température 37 °С. Dans intervalles à 1 minute on prend les essais des éprouvettes dans les éprouvettes nettes (0,3-0,5 ml) et on fait la réaction avec la solution de Lugol. On écrit les résultats (la couleur de la solution) dans le tableau. On fait l’hydrolyse pendant 5 minutes. On fait la conclusion de l’action (l’activation ou l’inhibition) des agents d’addition étudiés.
|
|
|
Observations:
| № éprouvette | 1 | 2 | 3 | |
| Agent d’addition | NaCl | CuSO4 | H2O | |
| Temps, min | 1 | |||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
Conclusion:
2. La détermination de l’activité de l’ α-amylase de la salive d’après Wolgemut.
Cette méthode se base sur la dilution limitante de la solution d’α-amylase où il y a aussi sous les conditions determinées le détachement de la quantité donnée d’amidon à l’érythrodextrine. On peut utiliser la méthode de Wolgemut pour déterminer l’
α-amylase dans le suc pancréatique, dans le sang, dans l’urine et dans les autres bioliquides. Mais cette méthode donne les résultats approximatifs.
On prend de la salive. On met 1 ml de salive dans l’éprouvette, on ajoute 9 ml d’eau distillée et on mélange. On reçoit la solution de salive (1:10).
On verse 1 ml d’eau dans 10 éprouvettes énumérées. Dans la première éprouvette on ajoute 1 ml de solution de salive et on mélange par la rétraction et la déflation du liquide de la pipette pendant 3 fois. Ensuite on place 1 ml de liquide de la première éprouvette dans la deuxième, en mélangeant le liquide de la même manière. Ensuite on place 1 ml de liquide de la deuxième éprouvette dans la troisième etc. Après le mélange dans la 10-ème éprouvette on élimine 1 ml de liquide.
On ajoute dans toutes les éprouvettes à partir de la 10-ème, 2 ml de solution d’amidon à 0,1 % et on mélange le contenu. On place les éprouvettes dans le thermostat à 37 °С à 30 minutes.
Dans 30 minutes on réfroidit les éprouvettes sous le robinet et on ajoute dans chaque éprouvette 1 goutte de la solution de Lugol. On écrit les résultats dans le tableau. On marque l’éprouvette avec la plus grande dilution de la salive où il y a le détachement de l’amidon à l’érythrodextrine qui donne avec l’iode la couleur rouge foncée.
On exprime l’activité de l’ α-amylase en quantité de millilitres de la solution d’amidon à 0,1 % qui peut détacher 1 ml de salive non diluée lors de la température 37 °С pendant 30 minutes jusqu’au stade de l’érythrodextrine.
Par exemple : si la couleur rouge foncée a été remarquée dans la 4-ème éprouvette où la salive a été diluée 160 fois. 1 ml de salive non diluée détacherait 160 fois plus de la solution d’amidon pendant 30 mintues lors de la température 37 °С: 2 ml×160 = 320 ml de solution d’amidon à 0,1 %. On le prend pour 320 unités de l’ α-amylase d’après Wolgemut: А37°/30' = 320 unités.
Observations:
| № épr | Dilution de la salive | Couleur en réaction avec l’iode |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 | ||
| 8 | ||
| 9 | ||
| 10 |
Calculs:
Questions de contrôle.
1. Quel est le rôle des enzymes dans l’organisme ?
2. A quelle classe des substances les enzymes, appartiennent-elles ?
3. Qu’est-ce que c’est le centre actif de l’enzyme ?
4. Quelles sont les particularités de l’action des enzymes en comparaison avec celle des catalyseurs inorganiques?
5. Pourquoi lors du bouillage des solutions d’ enzymes il y a leur inactivation ?
7. Quelle est l’influence du changement du milieu de pH sur l’activité des enzymes ? Pourquoi ?
8. Quel principe se trouve-il à la base de la détermination qualitative des enzymes ?
9. Qu’est-ce que c’est les activateurs et les inhibiteurs des enzymes ? Comment peut-on étudier leur influence sur l’action de l’enzyme ?
10. Citez les exemples de l’utilisation des enzymes dans la médecine.
Devoirs sur le sujet «Biochimie des protéines et des enzymes»
1. Ecrivez le peptide: Ser – Glu – Pro – Lys – Gys.
а) Trouvez le caractère du radical pour chaque acide aminé du peptide:
1. Hydrophile avec le groupe anionique
2. Hydrophile avec le groupe cationique
3. Hydrophile neutre
4. Hydrophobe
b) Quels acides aminés du peptide sont correspondants aux caractèristiques suivantes :
1. l’acide aminé C-terminal
2. l’imino-acide
3. l’acide diaminomonocarboxylique?
c) Quelle est la charge totale de ce peptide? Dans quel milieu se trouve le pKi de ce peptide ?
2. Ecrivez le peptide : Glu – Arg – Tyr – Asp – Met.
а) Trouvez le caractère du radical pour chaque acide aminé du peptide:
1. Hydrophile avec le groupe anionique
2. Hydrophile avec le groupe cationique
3. Hydrophile neutre
4. Hydrophobe
b) Quels acides aminés du peptide sont-ils correspondants aux caractèristiques suivantes :
1. l’acide aminé N-terminal
2. l’acide aminé avec le groupe guanidine
3. l’acide aminé monoaminodicarboxylique ?
c) Quelle est la charge totale de ce peptide lors du рН=7? Qu’est-ce que c’est le point isoéléctrique de la protéine, quel est le pKi de ce peptide (>7, =7 ou <7)?
3. Ecrivez le peptide: Val – Cys – Arg – Asp – Gln.
a) Trouvez le caractère du radical pour chaque acide aminé du peptide :
1. Hydrophile avec le groupe anionique
2. Hydrophile avec le groupe cationique
3. Hydrophile neutre
4. Hydrophobe
b) Quels acides aminés du peptide sont-ils correspondants aux caractèristiques suivantes :
1. l’acide aminé avec le groupe amidique
2. l’acide aminé avec le groupe guanidine
3. l’acide aminé monoaminodicarboxylique
c) Quelle est la charge totale de ce peptide ? Dans quel milieu se trouve le pKi de ce peptide ?
4. Ecrivez le peptide: Try – Leu – Glu – Tre – Arg.
а) Trouvez le caractère du radical pour chaque acide aminé du peptide:
1. Hydrophile avec le groupe anionique
2. Hydrophile avec le groupe cationique
3. Hydrophile neutre
4. Hydrophobe
b) Quels acides aminés du peptide sont-ils correspondants aux caractèristiques suivantes :
1. L’acide aminé avec le groupe hydroxile
2. l’acide aminé avec le groupe amidique
3. l’acide aminé hétérocyclique?
c) Quelles est la charge totale de ce peptide ? Dans quel milieu se trouve le pKi de ce peptide ?
5. Ecrivez le peptide: Tre – Lys – Glu – Tyr – Arg - Cys.
а) Trouvez le caractère du radical pour chaque acide aminé du peptide:
1. Hydrophile avec le groupe anionique
2. Hydrophile avec le groupe cationique
3. Hydrophile neutre
4. Hydrophobe
5. Aromatique.
b) Quels acides aminés du peptide sont-ils correspondantes aux caractèristiques suivantes :
1. L’acide aminé avec le groupe hydroxyle
2. l’acide aminé avec le groupe amidique
3. L’acide aminé avec du soufre ?
c) Quelle est la charge totale de ce peptide ? Dans quel milieu se trouve le pKi de ce peptide ?
6.Dans la chaîne polypeptidique on peut avoir les liasons chimiques entre les radicaux des acides aminés. Choisissez les paires d’acides aminés dont les radicaux peuvent former les laisons et indiquez le type de cette laison.
1. Ser, Asn 2. Ala, Val 3. Glu, Asp 4. Gys, Asp 5. Cys, Ala 6. Ser, Gln
7. Dans la chaîne polypeptidique on peut avoir les liasons chimiques entre les radicaux des acides aminés. Choisissez les paires d’acides aminés dont les radicaux peuvent former les laisons et indiquez le type de cette laison.
1. Asp, Lys 2. Val, Tre 3. Arg, Gys 4. Glu, Ser 5. Try, Ile 6.Tre, Gln
8. Dans la chaîne polypeptidique on peut avoir les liasons chimiques entre les radicaux des acides aminés. Choisissez les paires d’acides aminés dont les radicaux peuvent former les laisons et indiquez le type de cette laison.
1. Asp, Try 2. Asn, Tre 3. Arg, Lys 4. Glu, Gys 5. Met, Ile 6. Cys, Gln
9. Dans la chaîne polypeptidique on peut avoir les liasons chimiques entre les radicaux des acides aminés. Choisissez les paires d’acides aminés dont les radicaux peuvent former les laisons et indiquez le type de cette laison.
1. Asp, Met 2. Val, Ile 3. Ser, Gys 4. Glu, Arg 5. Try, Tre 6. Cys, Gln
10. Ecrivez la formule structurale de pentapeptide de la structure suivante :
Cys - Arg - Phe - Glu - Try
а) Indiquez les extrémités N et C du peptide.
b) Indiquez les groupes qui se répétent régulièrement, qui forment le squelette peptidique et les radicaux des acides aminés.
c) Quelles réactions colorées seront-elles positives avec ce peptide ?
11. Associez
А. Val-Gly-Ser-Met 1. Peptide qui rélie les nones Са+2 lors du рН=7
B Gys-Tre-Lys-Gln 2. Peptide qui à le pKt lors du рH>7
C. Glu-Try-Phe-Arg 3. Peptide qui a l’iminoacide sur l’extremité C
D. Cys-Glu-Phe-Asp
E. Asp-Tyr-Ile-Pro
12. Associez
А. Ser-Met-Gln-Arg 1. Peptide qui contient tous les acides aminés cycliques
B. Asn-Ser-Tre-Gln 2. Peptide qui a l’acide amine avec du soufre
C. Gly-Glu-Tre-Asp 3. Peptide qui contient tous les acides aminés hydrophobes
D. Phe-Try-Pro-Tyr
E. Ala-Ile-Val-Pro
Dans quel milieu se trouvent tous les points isoéléctriques de ces peptides?
13. Associez
A. Ser-Gys-Lys-Met 1. Peptide hydrodissoluble
B. Ala-Pro-Try-Phen 2. Peptide qui a la charge positive lors du pН=7
C. Tre-Cys-Arg-Asn 3. Peptide dont le pKt se trouve dans le milieu acide
D. Asn-Gys-Tyr-Lys
E. Tre-Glu-Ser-Asp
14. Tachez de prévoir dans quelle conformation seront les fragments peptidiques dans la protéine : dans l’a-spirale ou dans la composition de la b-structure:
а) poly-L-leucine;
b) poly-L-valine;
c) Pro-Glu-Met-Val-Phe-Asp-Ile;
d) Pro-Glu-Ala-Leu-Phe-Ala-Ala.
15. Tachez de prévoir dans quelle conformation seront les fragments peptidiques dans la protéine : dans l’a-spirale ou dans la composition de la b-structure:
а) poly-L-ala;
b) poly-L-phenala;
c) Ala-Glu-Met-Val-Phe-Met-Gln;
d) Pro-Val-Asp-Leu-Gly-Asn-Ala.
16. Tachez de prévoir dans quelle conformation seront les fragments peptidiques dans la protéine : dans l’a-spirale ou dans la composition de la b-structure::
а) poly-L-tyr;
b) poly-L-gys;
c) lys-met-ile-ala-gln-ala;
d) Phe-Ala-Val-Tre-Tyr-Val.
17. Quels peptides donneront-ils la réaction positive de Fol (la réaciton sulfhydryle) ? Expliquez votre réponse. Faites l’équation de Fol en l’écrivant avec l’acide aminé nécessaire.
а) NH2–Ala–Cys–Phe–Cys–СООН; c) NH2–Gly–Val–Gly–Ser–Ala–СООН;
b) NH2–Ser–Ala–Met–Pro–СООН; d) NH2–Gly–Cys–Cys–Ala–Ala–СООН.
18. Les protéines globulaires se caractérisent par la localisation déterminée des acides aminés spécifiques. D’après les coordonnées de l’analyse radiostructural de la myoglobine et des autres petites protéines globulaires à une chaîne on a fait les généralisations qui concernent de la mise des chaînes polypeptidique des protéines solubles. En vous basant sur ces généralisations, indiquez la localisation la plus possible (en dédans ou sur la surface de la molécule de la protéine globulaire native) des restes de l’acide aspartique, de la leucine, de la sérine, de la valine, de la glutamine et de la lysine. Exliquez votre réponse.
19. Les protéines globulaires se caractérisent par la localisation déterminée des acides amines spécifiques. D’après les coordonnées de l’analyse radiostructural de la myoglobine et des autres petites protéines globulaires à une chaîne, on a fait les généralisations qui concernent de la mise des chaînes polypeptidique des protéines solubles. En vous basant sur ces généralisations, indiquez la localisation la plus possible (en dédans ou sur la surface de la molécule de la protéine globulaire native) des restes de l’arginine, de la valine, de l’alanine, de l’acide glutamique, de la sérine. Exliquez votre réponse.
20. Quels peptides donneront-ils la réaction xanthogénique positive (les flèches dans la formule de la gramicydine S sont dirigées vers les acides aminés dont les groupes aminés participent à la formation des liaisons peptidiques) ? Expliquez votre réponse. Ecrivez l’équation de la réaction xanthogénique avec l’acide aminé nécessaire. Quelle est la bioactivité de la gramicidine S et de la glutatyon ?

21. Le pentapeptide qui est formé lors du traitement de la protéine par la trypsine, contient l’argynine, l’acide asparique, la leucyne, la sérine et la tyrosine. Pour déterminer la succession de l’acide aminé on a fait trois détachements successifs d’après Edmane.
Les peptides reçus après chaque détachement avaient la composition suivante :
Premier détachement – l’argynine, l’acide asparique, la leucyne, la sérine ;
Deuxième détachement – l’argynine, l’acide asparique, la sérine ;
Troisième détachement – l’argynine, la sérine.
Quelle est la succéssion du pentapeptide ?
22. Dans l’hydrolyse du peptide on a trouvé ala, val, glu, phe, tyr, gly, lys, leu, met et NH3. Lors du traitement du peptide selon la méthode de Sanger on a déterminé la DNP-alanine, par la carboxypeptidase – la glycine. Dans l’hydrolysate tryptique il y a 2 peptides: le premier se compose de val, ala, gln, lys, phe; le deuxième se compose de met, gly, leu, tyr lors du traitement selon Sanger il donne la DNP-leucine. Dans l’hydrolysate chimotryptique il y a 3 peptides: le premier se compose de met, gly; le deuxième - val, ala, phe, gln; le troisième - leu, tir, lys. A la base de l’ensemble des données faites la structure primaire du peptide initial.
23. Le tétrapeptide contient l’alanine, la lysine, la proline et la valine. A cause de la réaction du tétrapeptide avec le dinitrofluorbenzol et à cause de l’hydrolyse de DNP-peptide par la solution d’acide chlorydrique (6 mol/l) on a reçu la DNP-alanine. L’hydrolyse de tétrapeptide avec la trypcine donne deux composés l’un desquels est coloré par le ninhydrine en bleu-violet et l’autre devient jaune. Quelle est la structure primaire du tétrapeptide?
24. Déterminez la séquence des acides aminés dans le tétrapeptide en utilisant les données suivantes:
а) Lors de l’analyse de l’acide aminé N-terminal et de la composition de l’acide aminé on a reçu: Asp - (Pro, Tyr, Met);
b) Après l’hydrolyse avec le cyanogène bromide qui détache les liaisons avec le groupe carboxyle de la méthionine est formé le tripeptide qui contient Tyr, Met, Asp.
25. Ecrivez la formule structurale du peptide suivant:
(H2N)gly-gly-pro-try-met-glu-ala-tyr-gly-try-met-asp-phe (ОН).
Indiquez quels composés sont formés lors de l’influence du cyanogène bromide si ce dernier déclenche la liaison peptidique formée par la méthionine en transformant la méthionine en homoséryne lactone

26. Déterminez le point isoélectrique des composés indiqués dans le tableau lors de la température 25 °С, si on sait que pKa lors de cette température ont les valeurs suivantes:
| Composés | pKa1 | Pka2 |
| Glycine | 2,4 | 9,7 |
| Isoleucine | 2,36 | 9,68 |
| Sarcosine | 2,23 | 10,01 |
| Glycylglycine | 3,06 | 8,13 |
27. Déterminez le point isoélectrique des composés indiqués dans le tableau lors de la température 25 °С, si on sait que pKa lors de cette température ont les valeurs suivantes:
| Composés | pKa1 | Pka2 |
| α-alanine | 2,34 | 9,69 |
| β-alanine | 3,60 | 10,19 |
| Isoleucine | 2,36 | 9,68 |
| Glycilalanine | 3,15 | 8,25 |
28. Calculez les valeurs des points isoélectriques de la glycine, de l’acide aspartique et de la lysine. Les valeurs de pKa de ces acides aminés sont suivantes:
| Composés | pKa1 | pKa2 | pKa3 |
| Glycine | 2,4 | 9,7 | - |
| Acide aspartique | 1,9 | 3,7 | 9,6 |
| Lysine | 2,2 | 8,9 | 10,5 |
Dans quelles positions de la ligne de départ se trouvent les acides aminés nommés après leur fractionnement électrophorétique dans le système tampon avec le pH=6,5?
29. On a le mélange de protéines:
| Nom de protéine | Masse moléculaire | рI de protéine |
| Céruloplasmine | 151 000 | 4,4 |
| g- Globuline | 150 000 | 6,3 |
| b- Lactoglobuline | 37 100 | 5,2 |
Nommez les méthodes de différenciation des protéines et indiquez l’ordre de leur différenciation du mélange.
30. Lors de l’échauffement de courte durée jusqu’à 65 °С la plupart des protéines globulaires dénaturent avec la perte totale de l’activité. Pourtant les protéines globulaires qui contiennent de multiples résidus de cystine ne dénaturent que lors de l’échauffement durable jusqu’à la haute température. La ribonucléase est l’une de ces protéines, elle comprend 124 résidus d’acides aminés dans une seule chaîne polypeptidique contenante 4 liaisons transversales disulfuriques formées des résidus de cystine. Pour le retournement de la chaîne polypeptidique de la ribonucléase il est nécessaire de réchauffer la solution jusqu’à la haute température. Si refroidir vite la solution, l’activité enzymatique se rétablit. Pouvez-vous indiquez la base moléculaire de ce phénomène?
31. Lors de quelles valeurs de рН le fractionnement électrophorétique des mélanges protéiques suivants est le plus rationnel: а) la myosine et l’hémoglobine; b) l’uréase et l’hémoglobine; c) la phosphatase alcaline, l’albumine sérique et l’uréase; d) le cytochrome с et l’hémoglobine si le point isoiélectrique de la myosine est 5,4; de la phosphatase alcaline - 4,5; de l’hémoglobine - 6,8; de l’uréase - 5,0; du cytochrome с - 10,65; de l’albumine sérique – 4,6.
32. En utilisant les notations: К – la cathode, А – l’anode, С – la ligne de départ, indiquez la direction du déplacement des protéines suivantes lors de l’électrophorèse: а) de la tropomyosine dans le système tampon avec le рН=5,1; b) de l’hémoglobine – le рН=4,8; c) de la ribonucléase avec le рН=4,2; 9,5 et 11,3, si le point isoélectrique de la tropomyosine est 5,1, de l’hémoglobine - 6,8, de la ribonucléase - 9,45.
33. Le mélange d’acides aminés qui contient la valine, la leucine, l’acide asparatique, la lysine, l’histidine et la sérine a suibit le fractionnement selon la méthode d’électrophorèse sur le papier lors du pH=6,2. Quels des acides aminés indiqués se dirigent-ils vers la cathode, vers l’anode ou restent sur la ligne de départ?
34. On fait l’électrophorèse des acides aminés sur le papier: on a posé une goutte de solution qui contient le mélange de glycine, d’acide glutamique, de lysine, d’arginine et d’histidine au centre du papier et on a attendu le séchage de la goutte. Ensuite on a mouillé le papier avec la solution tampon avec le рН 6,0 et on a appliqué la tension électrique sur les extrémités du papier.
а) Quel(s) acide(s) aminé(s) se dirige-t-il vers l’anode?
b) Quel(s) acide(s) aminé(s) se dirige-t-il vers la cathode?
c) Quel(s) acide(s) aminé(s) reste-il au point de départ ou près de ce point?
35. Indiquez les structures complètes des peptides suivants (présentez les groupes ionisés en état protonique):
а) métionyleglutamine,
b) glutamyle-aspartyle-phényle-alanine,
c) Phen-Arg-Trp-Ile.
Est-il possible de diviser ces peptides selon la méthode d’électrophorèse? Expliquez la réponse.
36. On a fractionné le mélange de glycine, d’alanine, d’acide glutamique, de lysine, d’arginine et de sérine selon la méthode d’électrophorèse sur le papier lors du рН 6,0. Indiquez quels composés se sont dirigés vers l’anode - А (а), vers la cathode - К (b), ont resté au point de départ - С (c).
37. La protéine oligomérique avec la masse 660 mg a été traité par l’excès de 2,4-dinitrofluorbenzol dans le mileu faiblement alcalin jusqu’à l’achèvement de la réaction chimique. Ensuite les liaisons peptidiques de la protéine ont subit une hydrolyse complète à cause de l’échauffement de la protéine avec HCl concentré. Dans l’hydrolysate il y avait 5,5 mg de composé suivant:
 .
.
On n’a pas déterminé quelques autres dérivés de 2,4-dinitrofluorbenzol formés pendant la réaction avec les groupes α-aminés.
а) Expliuez pourquoi on peut utilliser ces données pour la détermination du nombre de chaînes polypeptidiques dans la protéine oligomérique.
b) Calculez le nombre de chaînes polypeptidiques dans cette protéine (la masse moléculaire est 132000).
38. Décrivez la structure du centre actif de l’hémoglobine et le rôle de l’histidine dans son foctionnement. Comment la structure du centre actif facilite-elle l’interaction de l’hème avec О2 et complique-t-elle son contact avec l’eau? Donnez l’exemple de l’hémoglobinopathie provoquée par les troubles de la structure du centre actif Нb.
39.Lessels des métaux lourds sont toxiques pour les organismes vivants. Expliquez le mécanisme de leur action toxique. Pourquoi lors de l’intoxication par les sels des métaux lourds comme premiers secours on peut donner boire à la victime le blan d’oeuf?
40.En quoi consiste la différence des premiers secours lors de l’intoxication par le monoxyde de carbone et par les nitrites?
41. Le cytochrome с comprend 0,426 % de fer. Calculez la masse molaire minimale de cette protéine.
42. Après l’incendie on a trouvé un cadavre. Comment à l’aide de l’analyse du sang peut-on déterminer facilement si l’homme est mort pendant l’incendie ou avant?
43. Les conditions optimales de l’action de l’amylase de l’enzyme qui dégrade l’amidon:
рН 6,8, t 37 °С. Comment l’activité des enzymes est-elle changée dans les cas suivants:
1) le рН du milieu incubatoire est égal à 5.
2) la température de l’incubation est 70 °С.
3) Dans le milieu d’incubation on ajoute la solution de sulfate de cuivre (ou de sulfate de plomb).
4) Est-ce que la présence de la solution de sulfate de cuivre (ou de sulfate de plomb) dans le milieu augmente la concentration d’amidon ou non?
Indiquez les causes du changement de l’activité de l’enzyme.
44. Le médicament contenant 2,0 mg d’arginase pendant 10 min lors du рН 9,0 a catalysé la formation de 30 mcmol d’urée. Calculez l’activité spécifique de l’arginase. Comment est changé l’activité de l’enzyme dans chaque cas:
1) Acidifier le milieu d’incubation jusqu’au рН 5,0.
 2) Ajouter au milieu le glycocyamine (NH2-C-NH-CH2-COOH).
2) Ajouter au milieu le glycocyamine (NH2-C-NH-CH2-COOH).
NH
3) Avec le glycocyamine augmenter la concentration de l’arginine dans le milieu
45. Pendant 15 min 0,05 mg de trypsine forment 100 mcmol de tyrosin lors des conditions optimales de l’incubation: рН 8,0 et 37 °С. Calculez l’activité spécifique de la trypsine si:
1) diminuer le рН du milieu d’incubation jusqu’à 3,0;
2) augmenter le milieu d’incubation jusqu’à 78 °С;
3) ajouter dans le milieu d’incubation le trasilol (polypeptide).
46. Pendant 5 min 1 mg d’enzyme de succinatedéhydrogénase catalyse l’oxidation de l’acide succinique avec la formation de 10 mcmol d’acide fumarique lors de 37 °С et lors du рН 7,0. Calculez l’activité spécifique de l’enzyme dans les conditions optimales. Expliquez comment et pourquoi l’activité de l’enzyme changera si:
1) le рН du mélange d’incubation est 4,0.
2) ajouter dans le milieu l’acide malonique.
3) avec la présence de l’acide malonique augmenter la concentration de l’acide succinique.
47. pendant 30 min 5 mg d’enzyme de lactate-déhydrogénase catalyse la transformation du pyruvate avec la formation de 20 mcmol de lactate lors de 37 °С et lors du рН 7,4. Comment et pourquoi l’activité de l’enzyme changera si:
1) le рН du mélange d’incubation est 10,0.
2) diminuer la concentration NAD+.
3) la température du mélange d’incubation est 10 °С?
48. Dans les conditions optimales (37 °С et рН 8,4) pendant 15 min la cholinestérase catalyse l’hydrolyse d’acétylcholine avec la formation de 100 mmol de choline et d’acide acétique. Calculez l’activité de l’enzyme. Expliquez comment et pourquoi l’activité de l’enzyme changera si:
1) changer la température du milieu d’incubation de 5 jusqu’à 40 °С.
2) diminuer le рН du milieu jusqu’à 3,0
3) ajouter dans le milieu d’incubation la prosérine:
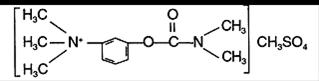 .
.
49. L’enzyme d’acétylcholineestérase catalyse l’hydrolyse d’acétylcholine du neurotransmetteur sécreté dans les synapses des nerfs cholinérgiques. L’hydrolyse de l’acétylcholine s’arrète à cause du kalymin – médicament utilisé lors des troubles moteurs après les traumas, les paralysies, pendant la période de rétablissement après la poliomyélite, l’encéphalite etc. L’inhibition de l’acétylcholineestérase est réflétée dans le schéma suivant:
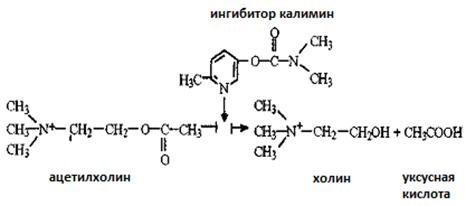
Comparez les formules structurales de l’inhibiteur et du substrat. Pourquoi on peut supposer que l’inhibiteur est lié avec l’enzyme dans le centre actif? Comment l’action du kalymin change-elle la transmission de l’influx nerveux (augmente, diminue ou ne change pas)?
50. On sait que l’anhydrase carbonique est fortement inhibée par l’acétasolamide utilisé comme diurétiques ou comme médicament lors du glaucome qui se carctérise par la tension occulaire augmentée. Dans ces processus sécréteurs l’anhydrase carbonique joue le rôle important car elle participe à la régulation du рН et à la présence du bicarbonate dans de plusieurs liquides de l’organisme humain. L’image représente la courbe expérimentale qui réflète la dépendance de la vitesse de la réaction catalysée par l’anhydrase carbonique de la concentration du substrat. Pendant l’exécution de l’expérience avec l’acétasolamide on reçoit la courbe inférieure. Selon l’analyse des courbes et vos connaissances sur les propriétés cinétiques des inhibiteurs compétitifs et non compétitifs des enzymes, déterminez la nature de l’inhibition de l’acétasolamide. Expliquez sur quoi est basée votre opinion.

51. Le goût sucrédes grainsde maïs s’explique d’une grande quantité de sucre. Les maïs vendus dans quelques jours après la récolte sont moins sucrés car près de 50 % de sucre libre dans les grains se transforment en amidon pendant 1 jour. Pour conserver le goût sucré des maïs ramassés on plonge l’épi épluché de maïs dans l’eau bouillante à quelques minutes (pour «blanchir») et ensuite on le refroidit dans l’eau froide. Le mais traité de telle manière et mis dans le congélateur conserve son goût sucré. En quoi consiste la base biologique de ce traitement ?
52.Le méthanol est très toxique: l’utilisation interne de 30 ml de méthanol peut provoquer la mort. La haute toxicité du méthanol s’explique par l’action des produits du métabolisme du méthanol par les formaldéhydes. Le méthanol s’oxyde vite jusqu’au formaldéhyde sous l’influence de l’enzyme du foie de l’alcooldéshydrogénase. L’une des méthodes du traitement pendant l’intoxication par le méthanol est la préscription au malade de l’éthanol à l’intérieur ou comme injection en quantité qui provoque l’intoxication de l’homme sain. Expliquez pourquoi ce traitement est efficace.
53. Après l’incubation avec n-chloromércuriobenzoate, la liaison de l’enzyme avec le substrat ne change pas par rapport à l’enzyme non traitée mais l’activité catalytique de l’enzyme diminue à 40 %. Quelle conclusion on peut faire de cette observation?
54. L’enzyme du glutamate déhydrogénase catlyse la réaction de la transformation de L-glutamate en α-cétoglutarate. Les données cinétiques de la dépendance du changement de la vitesse initiale de la réaction de la concentration de L-glutamate sont indiquées dans le tableau:
| Concentration L - glutamate, mmol/l | Vitesse initiale (formation de NADH+Н+, les unités de la densité optique) |
| 1,68 3,33 5,00 6,67 10,00 20,00 25,00 30,00 | 0,127 0,250 0,286 0,303 0,334 0,384 0,385 0,385 |
Trouvez Km et Vmax de cette réaction grace à la détermination de la dépendance classique selon Michaelis-Menten et selon la méthode de Lineweaver et de Burk.
55. Le glycogène est un polysaccharide qui se compose de résidu de glucose. L’enzyme de la glycogéne synthase responsable pour la croissance de la molécule de glycogène catalyse la réaction:
UDP - glucose + (glucose)n ® (glucose) n+1 + UDP.
Les données cinétiques de la dépendance du changement de la vitesse initiale de la concentration UDP-glucose sont indiquées dans le tableau:
| Concentration UDP - glucose, mmol/l | Vitesse initiale, mmol/min |
| 0,8 1,4 3,3 5,0 6,0 | 10,0 12,5 22,0 25,00 25,3 |
Déterminez Km et Vmax de cette réaction par la détermination de la dépendance de la vitesse initiale de la concentration du substrat selon Michaelis-Menten et selon la méthode de Lineweaver et de Burk.
56. La pénicilline est hydrolysée par l’enzyme bactérienne – la pénicillinase. Les données cinétiques de la dépendance du changement de la vitesse initiale de cette réaction de la concentration de la pénicilline sont indiquées dans le tableau:
| Concentration de la pénicilline, М | Quantité de la pénicilline hydrolysée, mol/min |
| 0,1·10-5 0,3·10-5 0,5·10-5 1,0·10-5 3,0·10-5 5,0·10-5 7,0·10-5 | 0,11·10-9 0,25·10-9 0,34·10-9 0,45·10-9 0,58·10-9 0,61·10-9 0,62·10-9 |
а) Selon ces données faites la graphique dans les coordonnées inverse. Est-ce que la pénicillinase soumet à la cinétique de Michaelis-Menten? Si oui, à quoi est égal Km de cette enzyme?
b) A quoi est égal Vmax?
57. On a déterminé la vitesse de la réaction enzymatique de la succinate déshydrogénase avec la présence de différentes concentrations de l’acide succinique. On a reçu les données suivantes:
| Concentration de succinate, M | Vitesse de la réaction, mcmol/min |
| 0,2·10-5 | 4.1 |
| 0,4·10-5 | 6.4 |
| 0,6·10-5 | 8,7 |
| 0,8·10-5 | 11,0 |
| 1,0·10-5 | 12,0 |
| 3,0·10-5 | 22,6 |
| 9,0·10-5 | 33,8 |
| 15,0·10-5 | 34,5 |
| 21,0·10-5 | 34,6 |
Déterminez la valeur de Km et Vmax de la succinate déshydrogénase .
58. On a déterminé la vitesse de la réaction enzymatique catalysée par la catalase avec la présence de différentes concentrations du peroxyde d’hydrogène. On a reçu les données suivantes:
| Concentration du peroxyde d’hydrogène, M | Vitesse de la réaction, mcmol/min |
| 0,3·10-5 | 10,4 |
| 0,5·10-5 | 14,5 |
| 1,0·10-5 | 22,5 |
| 3,0·10-5 | 33,8 |
| 9,0·10-5 | 40,5 |
| 13,0·10-5 | 41,5 |
| 16,0·10-5 | 41,6 |
A quoi est égal Vmax de cette réaction et Km de la catalase?
59. On a déterminé la vitesse de la réaction enzymatique catalysée par le rybozime avec la présence de différentes concentrations de l’ARN. On a reçu les données suivantes:
| Concentration de l’ARN, M | Vitesse de la réaction, mcmol/min |
| 0,1·10-4 | 1,3 |
| 0,3·10-4 | 2,1 |
| 0,5·10-4 | 2,9 |
| 0,7·10-4 | 3,5 |
| 1,0·10-4 | 4,5 |
| 3,0·10-4 | 6,8 |
| 9,0·10-4 | 8,1 |
| 15,0·10-4 | 8,5 |
| 18,0·10-5 | 8,6 |
Faites le graphique de Lineweaver et de Burk d’après ces données et déterminez la valeur de Km pour le ribozyme.
60. On a mesuré la cinétique de la réaction enzymatique du lysosyme en dépendance de la concentration de la muréine. On a reçu les données suivantes:
| Concentration de la muréine, M | Vitesse de la réaction, mcmol/min |
| 2,5·10-6 | 28 |
| 4,0·10-6 | 40 |
| 1,0·10-5 | 70 |
| 2,0·10-5 | 95 |
| 4,0·10-5 | 112 |
| 1,0·10-4 | 128 |
| 2,0·10-3 | 139 |
| 1,0·10-2 | 140 |
Déterminez Km du lysozyme et Vmax.
61. Pendant la détermination de l’activité catalytique de la péptidase de l’intestin grêle hydrolysante le dipeptide glycyleglycine selon le schéma: glycyleglycine + H2O → 2 glycine, on a reçu les données suivantes:
| [S], мМ | 1,5 | 2,0 | 3,0 | 4,0 | 8,00 | 16,00 | 24,00 |
| V, mg/min | 0,21 | 0,24 | 0,28 | 0,33 | 0,40 | 0,45 | 0,46 |
D’après ces données déterminez par la voie graphique les valeurs de Km et de Vmax pour cette enzyme.
62. On a mesuré la cinétique de la réaction enzymatique en dépendance de la concentration du substrat avec la présence ou avec l’absence de l’inhibiteur. On a reçu les données suivantes:
| [S], M | Vitesse de la réaction, mcmol/min | |
| sans inhibiteur | avec l’inhibiteur | |
| 0,3·10-5 | 10,4 | 4,1 |
| 0,5·10-5 | 14,5 | 6,4 |
| 1,0·10-5 | 22,5 | 11,3 |
| 3,0·10-5 | 33,8 | 22,6 |
| 9,0·10-5 | 40,5 | 33,8 |
а) A quoi sont égaux Vmax et Km sans inhibiteur et avec l’inhibiteur?
b) Quel est le type d’inhibition?
c) A quoi est égal la constante d’inhibition?
63. La décraboxylation du glyoxylate par les mitochondries est inhibée par le malonate. Pendant les recherches cinétiques on a reçu les données suivantes:
| Concentration du glycoxylate, mМ | Vitesse du dégagement de СО2 (unités standards) | ||
| Sans malonate | Lors de la concentration du malonate 1,26 mМ | Lors de la concentration du malonate 1,96 mМ | |
| 1,00 | 2,50 | 2,17 | 1,82 |
| 0,75 | 2,44 | 1,82 | 1,39 |
| 0,60 | 2,08 | 1,41 | 1,28 |
| 0,50 | 1,89 | 1,30 | 1,00 |
| 0,40 | 1,67 | 1,09 | - |
| 0,33 | 1,39 | - | - |
| 0,25 | 1,02 | - | 0,56 |
Est-ce que le malonate est l’inhibiteur compétitif?
64. On a mesuré la cinétique de la réaction enzymatique en dépendance de la concentration du substrat avec l’inhibiteur ou sans inhibiteur. On a reçu les données suivantes:
| [S], М | Vitesse de la réaction, mcmol/min | |
| Sans inhibiteur | Avec l’inhibiteur | |
| 0,3·10-5 | 10,4 | 4,1 |
| 0,5·10-5 | 14,5 | 6,4 |
| 1,0·10-5 | 22,5 | 11,3 |
| 3,0·10-5 | 33,8 | 22,6 |
| 9,0·10-5 | 40,5 | 33,8 |
а) A quoi sont égaux Vmax et Km sans inhibiteur? Avec l’inhibiteur?
b) A quel type d’inhibition appartient ce cas?
65. Trouvez les différences:
а) les hydrolases et les hydratases,
b) les phosphatases et les phosphorylases,
c) les exopeptidases et les endopeptidases,
d) la pepsine et la cathepsine,
e) la trypsine et la chimotrypsine,
f) la trypsine et le trypsinogène.
66. Choisissez les paires correctes de mots ou de fragments des phrases (marquées par les lettres А, B, C, D, E) et des propositions avec le sens achevé (marquées par les lettres а, b, c, d, e).
А. Oxydase. B. Déshydrogénase. C. Catalase. D. Peroxydase. E. Hydratase.
а) accélère a réaction Н2О2 + АН2 ® 2Н2О + А
b) catalyse la transformation R-CH2-CH(OH)-R’ « R-CH= CH-R’ + Н2О
c) accélère le processus АН2 + O2 ® A + Н2О
d) assure l’accélération de la réaction catalytique: АН2 + B ® A + BH2
e) augmente catalytiquement la vitesse de la réaction: 2Н2О2 ® 2Н2О + O2
67. Choisissez les paires correctes de mots ou de fragments des phrases (marquées par les lettres А, B, C, D, E) et des propositions avec le sens achevé (marquées par les lettres а, b, c, d, e).
А. Hydrolase. B. Lyase. C. Transférase. D. Isomérase. E. Oxydoréductase.
а) catalyse la transformation:
méthyle malonyl -CоА + pyruvate « propionyl-CоА + acide oxaloacétique
b) accélère la réaction:
UDP-glucose « UDP-galactose
c) assure l’accélération de la réaction:
acide oxaloacétique « acide pyruvique + СО2
d) accélère catalytiquement le processus:
H2N-CO-NH2 + Н2О « СО2 + 2NH3
e) accélère catalytiquement le processus:
lactate + NAD+ « NADH + Н+
68.On a étudié la résistance de deux différentes enzymes (hexohinase et ribonucléase) à l’action de la température. On a decouvert que lors de l’échauffement des enzymes à 50 °С pendant 15 min l’hexohinase perd 70 % de son activité tandis que la ribonucléase ne perd que 30 %. En comparant la structure de ces enzymes on a decouvert que la ribonucléase contient dans sa structure 4 liaisons disulfidiques. Selon les données expliquez la différence de la résistance de deux enzymes à la dénaturation par la chaleur.
Les questions pour le colloque «La biochimie des protéines et des enzymes»
1. L’objet et les objectifs de la chimie biologique et clinique. La notion de réactions biochimiques.
2. Les acides aminés sont des monomères structuraux des protéines. La caractéristique générale, la classification (polaires, non polaires, polaires non chargés), les caractères.
3. La spécificité de la structure primaire de protéine. Les particularités de la formation de la liaison peptidiques. Le rôle déterminant de la structure primaire dans la formation des niveaux plus hauts de l’organisation de la molécule protéique.
4. La structure secondaire des protéines. Les liaisons stabilisantes de la structure secondaire. L’α-spirale. Les facteurs qui troublent la spiralisation. Les feuillets b-plissés, les particularités de la composition conformationnelle.
5. La structure tertiaire des protéines. Les liaisons qui stabilisent la structure tertiaire (covalentes, ioniques, hydrophobes, hydrogènes, de Van der Waals).
6. La structure quaternaire des protéines. La notion de monomères et d’oligomères. La dépendance des propriétés des protéines de leur confirmation. L’interaction de la structure et des fonctions.
7. La notion de «protéine native». La notion de protéines allostériques.
8. Les fonctions essentielles des protéines simples et complexes dans l’organisme: structurale, catalytique, réceptrice, régulatrice, de transport, protéctrice, contractile et d’autres.
9. La composition des protéine dans les tissus et dans les organes. La taille de la molécule protéique. Les méthodes de la détermination de la masse moléculaire des protéines (la filtration sur gel, l’ultracentrifugation, l’électrophorèse sur disque).
10. La solubilité des protéines dans l’eau. La dépendance de la solubilité de la composition des acides aminés dans les protéines. Les caractères physico-chimiques des solutions aqueuses des protéines. La notion de point isoélectrique.
11. La dénaturation et la rénaturation des protéines. Les agents dénaturants (physiques et chimiques). L’utilisation du phénomène de dénaturation dans la clinique. La réaction de sédimentation des protéines dans les solutions aqueuses. Le relargage des protéines. La réversibilité du processus. L’utilisation du relargage en médecine.
12. Des protéines simples. Les principes de leur classification. Des protéines globulaires. Les fonctions des albumines et des globulines du plasma du sang. Les praticularités de la composition et la fonction des histones et des protamines. Des protéines fibreuses (la myosine, le collagène, l’élastine, la kératine).
13. Des protéines complexes, leur classification. Les métalloprotéines et leurs fonctions dans l’organisme.
14. L’hémoglobine А, la structure et la fonction. Les formes allostériques de l’hémoglobine. L’hémoglobinopathie. La structure, la ressemblance structurale et la différence des molécules de l’hémoglobine et de la myoglobine.
15. Les protéines essentielles du système immunitaire. Les anticorps. Т-récepteurs et les protéines du complexe principal de l’histocompatibilité.
16. Les acides nucléiques: ADN et ARN, les structures primaire et secondaire. La spécificité typologique des acides nucléiques. Les nucléoprotéines, la structure et les fonctions.
17. La nature chimique, la structure et les fonctions des enzymes, la caractéristique des cofacteurs et des coenzymes, leur rôle dans la catalyse.
18. La notion de centres actifs des enzymes. Un centre allostérique. Des enzymes allostériques.
19. Les isoenzymes. Des systèmes enzymatiques multimoléculaires. Les unités de l’activité enzymatique.
20. Le mécanisme de l’action des enzymes.
21. La classification des enzymes. Les exemples.
22. La cinétique des réactions enzymatiques. La connexion du substrat avec l’enzyme. La notion de constante de Michaelis. L’équation de Michaelis-Menten.
23. La régulation de l’activité des enzymes. Les activateurs et les inhibiteurs des enzymes. Les types d’inhibition des enzymes: réversible et irréversible; compétitive et non compétitive.
24. L’influence du рН et de la température sur la vitesse des réactions enzymatiques. La spécificité de l’action des enzymes.
25.L’importance des enzymes pour la régulation du métabolisme. L’utilisation des enzymes en médecine.
Дата добавления: 2018-05-12; просмотров: 1077; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
