Опыт 2. Искусственные полимеры. Получение медно-аммиачного шелка.
Лабораторная работа №3
Природные, искусственные и синтетические полимеры. Получение и свойства.
Цель работы:изучение свойств природных полимеров, получение синтетических и искусственных высокомолекулярных соединений (ВМС).
Реактивы и материалы: концентрированная серная кислота; вата (или фильтровальная бумага), 30% раствор NaOH, универсальная лакмусовая бумага, раствор Фелинга I, раствор Фелинга II . CuSO4 ·5H2O, 25% раствор NH4OH, 10% раствор H2SO4, 30% раствор NaOH, целлюлоза (вата), фенол (0,7г); формалин-35-40% водный раствор формальдегида(1,4мл), соляная кислота (концентрированная); этиловый спирт.
Оборудование:фарфоровая ступка с пестиком, термостойкий стакан (50 мл), электроплита, мерные цилиндры , технические весы, магнитная мешалка с перемешивающим стержнем, стаканы 200мл и 100мл, медицинский шприц на 5мл (10мл), стеклянные палочки, водяная баня; широкая пробирка; держатель для пробирки; гранулы силикагеля; сливные пипетки, резиновая груша; капельницы.
Высокомолекулярные соединения (ВМС или полимеры) – соединения, относительная молекулярная масса которых достигает нескольких десятков тысяч и даже миллионов. Различают природные, искусственные и синтетические ВМС.
Природные полимерные вещества являются основой Жизни на Земле. Органические природные полимеры – биополимеры (нуклеиновые кислоты (ДНК, РНК), белки или полипептиды), полисахариды (целлюлоза, гликоген, крахмал), полиизопрены (натуральный каучук, гуттаперча и др.)
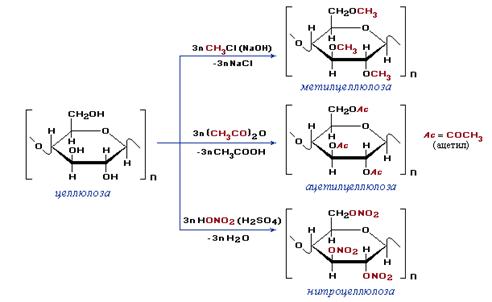
Полимеры, полученные при химической модификации природных полимеров, называют искусственными. Например, метилцеллюлоза, ацетилцеллюлоза (ацетатный шелк), нитроцеллюлоза — продукты химических превращений природного полимера – целлюлозы:
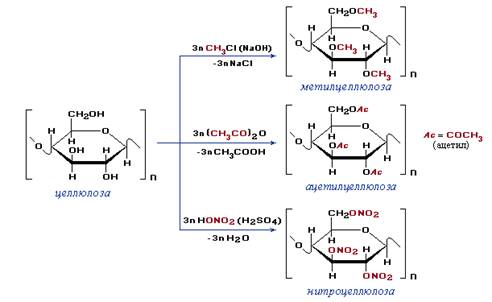
Синтетические полимеры получают химическим путем из низкомолекулярных природных или синтетических веществ методами полимеризации или поликонденсации (полиэтилен, полистирол, фенолоформальдегидная смола, найлон и т.д.). При получении полимеров методом полимеризации образующиеся из мономеров продукты (полимеры) имеют одинаковый с мономером элементарный состав, но обладают более высокой массой. При получении же полимеров методом поликонденсации соединение между собой молекул мономеров происходит с выделением побочных низкомолекулярных веществ, например воды, аммиака и др. Следовательно, конденсационный полимер, не имеет того же состава, что молекулы мономера, из которого он получен.
Полимеры широко используются для получения композитов, зачастую с уникальными физико-химическими свойствами и привлекательными потребительскими качествами.
Опыт 1. Свойства природных полимеров. Гидролиз целлюлозы
Полисахариды - это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. Эти вещества составляют основную массу органических соединений в биосфере Земли. В живой природе они выполняют важные биологические функции, выступая в качестве:
· структурных компонентов клеток и тканей,
· энергетического резерва,
· защитных веществ.
Полисахариды являются продуктом реакции поликонденсации моносахаридов.
Основные представители полисахаридов – крахмал, целлюлоза и гликоген – построены из остатков одного моносахарида – глюкозы. Эти полисахариды имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства. Это объясняется особенностями их пространственного строения. Крахмал и гликоген состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы, которая выделена пунктиром на рисунке:
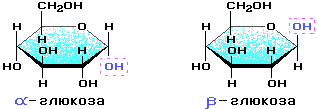
С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:
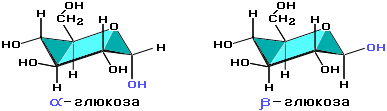
В растворе циклическая (полуацетальная) форма глюкозы находится в равновесии с. ациклической (альдегидной) формой:
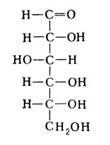
Из химических свойств полисахаридов большое значение имеет реакция гидролиза.
Гидролиз полисахаридов происходит в разбавленных растворах минеральных кислот (или под действием ферментов). При этом в макромолекулах разрываются связи, соединяющие моносахаридные звенья - гликозидные связи. Реакция гидролиза полисахаридов является обратной процессу их образования из моносахаридов.
Полный гидролиз полисахаридов приводит к образованию моносахаридов (целлюлоза, крахмал и гликоген гидролизуются до глюкозы):
(C6H10O5)n + nH2O 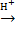 nC6H12O6
nC6H12O6
Целлюлоза. Молекулярная масса целлюлозы - от 400 000 до 2000000, степень полимеризации n от нескольких сотен до 10000-14000. Целлюлоза относится к наиболее жесткоцепным полимерам, в которых практически не проявляется гибкость макромолекул.
Химические свойства целлюлозы определяются прежде всего присутствием гидроксильных групп.
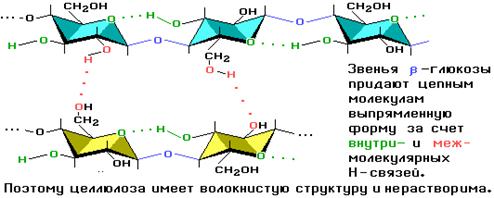
Одно из наиболее характерных свойств целлюлозы – способность в присутствии кислот подвергаться гидролизу с образованием глюкозы.
Гидролиз целлюлозы проводят в кислой среде, при этом сначала образуется целлобиоза, а затем глюкоза:
Ниже представлена схема гидролиза целлюлозы
Цель работы:изучение кислотного гидролиза целлюлозы.
Выполнение опыта:
Внимание! При проведении опыта обязательно используются резиновые перчатки!
В фарфоровую ступку помещают небольшой кусочек ваты, приливают 1 мл концентрированной серной кислоты и растирают вату пестиком до получения густой кашицы. В случае неполного смачивания ваты добавляют еще несколько капель кислоты.
Затем в ступку наливают 10–15 мл воды, растворяют в ней кашицу при тщательном перемешивании стеклянной палочкой и выливают раствор в термостойкий стакан на 50мл. Полученный раствор кипятят примерно 5-7 минут на электроплите с закрытой спиралью (раствор упаривают наполовину, примерно до 8мл). Далее раствор снимают с плитки и охлаждают до комнатной температуры, поместив его в другой стакан с небольшим количеством холодной воды. Раствор нейтрализуют, добавляя 3мл 30% раствора NaOH. Если раствор имеет pH<7, то добавляют по каплям NaOH до pH ~ 6-8 (для контроля используют универсальную индикаторную бумагу).
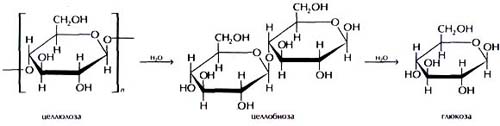
Для доказательства образования глюкозы в процессе гидролиза, проводят качественную реакцию на глюкозу (реакция Фелинга ). Для этого в стакан на 50 мл приливают 10 мл раствора гидролизата и 10 мл реактива Фелинга (5мл раствора Фелинга I и 5мл раствора Фелинга II). Смесь перемешивают и нагревают на плитке. Если в гидролизате присутствует глюкоза, то по мере нагревания синий цвет реактива Фелинга будет изменяется. Первоначально появится желтый осадок гидрата закиси меди, который постепенно перейдет в закись меди и выпадает в виде ярко-красного осадка. Ниже приведена схема реакции альдегидов с реактивом Фелинга:
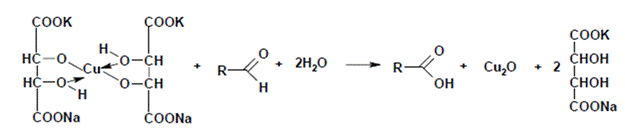
Оформление опыта
1. Запишите структурную формулу β-глюкозы, из остатков которой состоит целлюлоза.
2. Запишите реакцию гидролиза целлюлозы.
3. Запишите реакцию глюкозы с реактивом Фелинга.
4. Отметьте наблюдения, сделайте выводы.
Опыт 2. Искусственные полимеры. Получение медно-аммиачного шелка.
Цель работы:получение раствора целлюлозы в реактиве Швейцера и формирование волокон медно-аммиачного шелка.
Структурное звено целлюлозы содержит три реакционноспособные гидроксильные группы и легко вступает в химические превращения, образуя различные модифицированные искусственные полимеры, такие как метилцеллюлозу, ацетилцеллюлозу (ацетатный шелк), нитроцеллюлозу.
Медно-аммиачное волокно получается формованием целлюлозы из высоковязких прядильных растворов. Растворение химически очищенной целлюлозы в реактиве Швейцера (водный раствор гидроксида тетрааммиаката меди [Cu(NH3)4](OH)2) является одним из наиболее старых, известных уже с конца XIX в. способов перевода целлюлозы в раствор. Получающиеся при этом темно-синие высоковязкие растворы целлюлозы обладают способностью вытягиваться в тончайшие нити и при разложении прядильного раствора кислотами, щелочами или солями легко формуются в волокна и пленки.
Строение и свойства образующегося при этом медно-целлюлозного комплексного соединения еще не вполне выяснены, поэтому схему образования медно-аммиачного полимера условно можно изобразить следующим образом:
а) при взаимодействии водного раствора сульфата меди с гидроксидом аммония последовательно образуются [Cu(OH2)2 (NH3)2] SO4 и [Cu(NH3)4] SO4 :
CuSO4 + 4NH4OH → [Cu(NH3)4] SO4 + 4H2O;
б) при нейтрализации водного раствора комплексной медно-аммиачной соли щелочью (NaOH) , образуется соответственно медно-аммиачное основание:
[Cu(NH3)4] SO4 + 2NaOH →[Cu(NH3)4](ОН) 2 + Na2SO4 ;
в) в результате процесса растворения целлюлозы в медно-аммиачном основании образуется полимер (медно-аммиачный шелк):
(C6HI0O5)n + 3n[Cu(NH3)4](OH)2 →{(C6H7O5Cu)2[Cu(NH3)4]}n + 8nNH3 + 6nH2O.
Выполнение опыта
Внимание! Приготовление растворов в данном опыте обязательно проводится в вытяжном шкафу с соблюдением правил техники безопасности.
На технических весах взвешивают 13г CuSO4 ·5H2O, навеску переносят в стакан на 200мл и растворяют в 50мл теплой воды. К полученному раствору добавляют 40мл 25% раствора NH4OH. При этом образуется темно-синий раствор комплексной соли меди [Cu(NH3)4]SO4. Далее к раствору добавляют 8,6 мл 30% раствор NaOH. Раствор перемешивают стеклянной палочкой.
На весах взвешивают 2г 100% целлюлозы (хлопковой ваты), погружают её в раствор комплексной соли меди и оставляют на 2-5 дней для полного растворения.
Через 2 дня (5дней) в стакан ёмкостью 200мл добавляют 75 мл 10% раствора H2SO4. Стакан ставят на магнитную мешалку, а в раствор помещают стержень для перемешивания. Включают магнитную мешалку.
В медицинский шприц (без иглы) набирают полученный вязкий раствор целлюлозы. На шприц надевают иглу, погружают её в раствор кислоты и медленно, равномерно выдавливают раствор целлюлозы.
Полученную медно-аммичную шелковую нить достают пинцетом из стакана, тщательно промывают в воде и помещают в чашку Петри, для дальнейшего высыхания.
Оформление опыта
1. Запишите структурную формулу β-глюкозы, из остатков которой состоит целлюлоза
2. Запишите схему образования медно-аммиачного шелка.
3. В чем заключается экструзионный метод формования нитей? Является ли способ, которым получена нить в лабораторной работе, моделью экструзионного метода?
Опыт 3. Синтетические полимеры. Получение фенолоформальдегидной смолы Синтез полимеров.
Цель работы:синтез феноло-формальдегидных смол линейного и сетчатого строения, изучение их свойств.
Реакции получения полимеров делятся на две группы: реакции полимеризации и реакции поликонденсации.
Поликонденсация –процесс образования макромолекул из мономерных соединений, сопровождающийся отщеплением низкомолекулярных продуктов (воды, аммиака, хлороводорода и др.) Необходимым условием образования макромолекул является присутствие в молекулах исходных мономеров не менее двух реакционноспособных функциональных групп.
Поликонденсация фенола с формальдегидом. Взаимодействие фенола с формальдегидом в присутствии кислоты или основания, являющихся катализаторами, приводит к образованию полимера. В полученном полимере большое число фенольных колец связано посредством групп –СН2-:
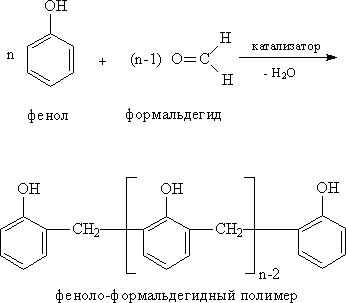
Механизм реакции на первой стадии может трактоваться либо как электрофильное замещение в кольцо под действием электорфильного атома углерода формальдегида, либо как нуклеофильное присоединение фенольного кольца по карбонильной группе.
Образующиеся на первой стадии изомерные фенолоспирты (о- или п-гидроксибензойные спирты), конденсируются далее с отщеплением воды, давая высокомолекулярные продукты. Взаимодействие фенола с формальдегидом идет по схеме:
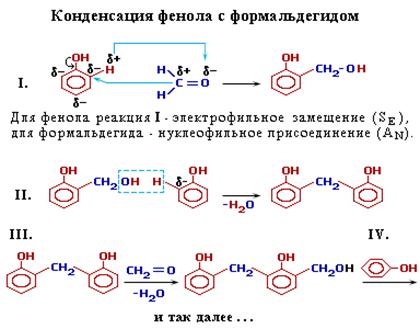
Роль реакционноспособных функциональных групп в этих соединениях играют:
- в феноле – три С-Н-связи в орто- и пара-положениях (легче идет замещение в двух орто-положениях);
- в формальдегиде – двойная связь С=О, способная к присоединению по атомам С и О.
Это определяет возможность образования цепных макромолекул по схеме поликонденсации:
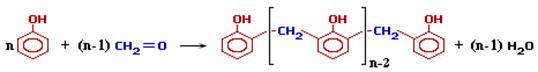
При избытке фенола и кислом катализаторе образуется линейный полимер – новолак(новолачная смола), цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми (–СН2–) мостиками.
Новолаки – термопластичные полимеры, которые сами по себе не способны переходить в неплавкое и нерастворимое состояние. Но они могут превращаться в трехмерный полимер при нагревании их с дополнительной порцией формальдегида в щелочной среде. При использовании щелочных катализаторов и избытка альдегида в начальной стадии поликонденсации получаются линейные цепи резола:
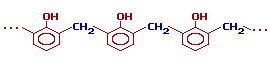
Молекулярная масса, как резолов, так и новолачных смол относительно мала (до 2000), поэтому и те и другие легкоплавки, хорошо растворимы в органических растворителях. При дополнительном нагревании (до 150-160 С°) линейные цепи "сшиваются" между собой за счет групп -СН2-, находящихся в пара- положении фенольного кольца, с образованием трехмерного полимера – резита:
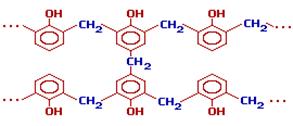
Таким образом, резиты являются термореактивными олигомерами. Полимеры, которые при повышенной температуре приобретают пространственную (сетчатую) структуру и становятся неплавкими и нерастворимыми, называются термореактивными. Термореактивные полимеры (реактопласты) состоят из макромолекул, соединенных поперечными ковалентными, то есть химическими связями. Образовавшаяся сетчатая химическая структура необратима. Нелимитированное нагревание сетчатых полимеров приводит не к расплавлению, а к разрушению пространственной сетки, сопровождающемуся термодеструкцией. С точки зрения практики это означает, что реактопласты допускают лишь однократную переработку в изделия, которые формуются в результате химической реакции отверждения.
Фенолоформальдегидные олигомеры применяются в виде прессовочных композиций с различными наполнителями, а также в производстве лаков и клея.
Выполнение опыта
Дата добавления: 2018-05-12; просмотров: 1475; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
