Учебно-методическая литратура
1. Белик В.В. Киенская К.И. Физическая и коллоидная химия-М.: Академия, 2008.
2. Горбунцова С.В. Физическая и коллоидная химия (в общественном питании) –М., «Альфа-М» ; «ИНФРА-М» ; 2010г.
3. Липатников В.Е., Казаков К.М. Физическая и коллоидная химия.-М.: Высшая школа, 2005.
4. Ищенко А.А. Аналитическая химия (СПО).- М.: Академия, 2007.
5. Жванко Ю.Н., Панкратова Г.В. Аналитическая химия и технохимический контроль в общественном питании.-М.: Высшая школа, 1989.
6. Саенко О.Е. Аналитическая химия: учебник для средних профессиональных учебных заведений. - Ростов – на –Дону: Феникс, 2009.
7. Гурецкая В.Л. Общая химия.-М.: Высшая школа, 2004.
8. Пустовалова Л.М. Органическая химия.-Ростов-на-Дону: Феникс, 2005.
Дополнительная литература
9. Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник – М.: Академия, 2013.
10. Габриелян О.С. Химия в тестах, задачах и упражнениях: учебное пособие.- 7-е изд., стер.-М.: Академия, 2012.
11. Шапиро С.А. Шапиро М.А. Аналитическая химия-М., «Высшая школа», 2006.
ПРИЛОЖЕНИЕ
Таблица. Стандартные энтальпии образования
И стандартные энтропии некоторых веществ
| Вещество | Состояние | ΔH0ƒ,298,кДж/моль | S0298, Дж/моль∙К |
| Al2O3 | тв | – 1676 | 50,92 |
| Al2(SO4)3 | тв | – 3434,0 | 239,2 |
| С (графит) | к | 0 | 5,74 |
| С (алмаз) | к | 1,897 | 2,38 |
| C | г | 716 | |
| CO | г | – 110,5 | 197,5 |
| CO2 | г | – 393,5 | 213,7 |
| CH4 | г | – 74,86 | 186,19 |
| C2H2 | г | 218,2 | 200,6 |
| С2H4 | г | 52,25 | 219,0 |
| С2H6 | тв | – 84,6 | 229,1 |
| CH3OH | ж | – 227,6 | 160,7 |
| С2H5OH | ж | – 277,6 | 160,7 |
| CH3COOH | ж | – 484,9 | 159,8 |
| H3COOС2H5 | ж | -479,3 | 257,7 |
| Ca | тв | 0 | 41,62 |
| CaO | тв | – 635,5 | 39,7 |
| CaCl2 | тв | – 785,8 | 113,8 |
| Ca(OH)2 | тв | – 986,6 | 83,4 |
| СаСО3 | тв | – 1206,0 | 92,9 |
| CaSO4 | тв | – 1424,0 | 106,7 |
| Cl2 | г | 0 | 223,0 |
| HCl | г | – 92,30 | 186,7 |
| HCl | ж | – 167,5 | 55,2 |
| Fe | тв | 0 | 27,15 |
| FeO | тв | – 264,8 | 60,75 |
| Fe2O3 | тв | – 822,2 | 60,75 |
| Fe(OH)2 | тв | – 561,7 | 88 |
| Fe(OH)3 | тв | – 826,6 | 105 |
| FeCl2 | тв | – 341,0 | 119,66 |
| FeCl3 | тв | – 405,0 | 130,1 |
| H2 | г | 0 | 130,52 |
| H2O | г | – 241,84 | 188,74 |
| H2O | ж | – 285,84 | 69,96 |
| H2O2 | ж | – 187,36 | 105,86 |
| K | тв | 0 | 64,35 |
| КOH | тв | – 425,8 | 59,41 |
| Na | тв | 0 | 51,42 |
| NaOH | тв | – 426,6 | 64,18 |
| NaCl | тв | – 410 | 72,36 |
| O2 | г | 0 | 205,03 |
| О3 | г | 142,3 | 238,8 |
| S (ромб.) | тв | 0 | 31,88 |
| SO2 | г | –296,9 | 248,1 |
| SO3 | г | –395,2 | 256,23 |
| H2S | г | –20,15 | 205,64 |
| H2S | ж | –39,33 | 122,2 |
| H2SO4 | ж | –811,3 | 156,9 |
Способы выражения концентраций растворов и их взаимосвязь
|
|
|
|
|
|
Массовая доля (процентная концентрация): ω = 
Молярная концентрация: с =  (моль/л)
(моль/л)
Моляльность: сm (B) =  (моль/кг)
(моль/кг)
Нормальность: сн = 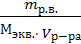 (·1000) =
(·1000) =  =
= 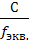 (моль/л)
(моль/л)
Мекв. = fэкв. · М
Титр раствора: Т =  (г/мл)
(г/мл)
Титр по определяемому веществу: Т(А/В) = 

 сн =
сн = 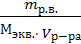 (·1000)
(·1000)
mр.в. = 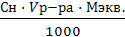 V =
V = 
 Т =
Т =  ; Т =
; Т = 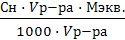 =
=  ; Т(А/В) =
; Т(А/В) = 
Сн = 

Дата добавления: 2018-05-12; просмотров: 488; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
