Основные законы химии. Закон сохранения массы вещества, его значение в химии. Закон постоянства состава вещества. Закон Авогадро и его следствия. Число Авогадро.
Предмет и задачи химии. Место химии среди естественных наук
Химия — наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Задачи:
• изучение веществ, их свойств и прогнозирование использования веществ в народном хозяйстве;
• получение различных веществ, необходимых в народном хозяйстве;
• разработка и использование новых источников энергии;
• охрана окружающей среды;
• освоение органических и неорганических источников сырья.
Химия изучает состав, свойства и превращения веществ, а также явления, которые сопровождают эти превращения.Одно из первых определений химии как науки дал русский ученый М.В. Ломоносов: «Химическая наука рассматривает свойства и изменения тел состав телобъясняет причину того, чтос веществами при химических превращениях происходит».По Менделееву, химия — это учение об элементах и их соединениях.
Химия относится к естественным наукам, которые изучают окружающий нас мир. Она тесно связана с другими естественными науками: физикой, биологией, геологией. Химия, физика, биология только на первый взгляд могут показаться далекими друг от друга науками. Хотя лаборатории физика, химика и биолога очень непохожи, все эти исследователи имеют дело с природными (естественными) объектами. Это отличает естественные науки от математики, истории, экономики и многих других наук, изучающих то, что создано не природой, а прежде всего самим человеком.
|
|
|
Объектом изучения химии являются вещества. Обычно их подразделяют на смеси и чистые вещества. Среди последних выделяют простые и сложные. Простых веществ известно более 400, а сложных веществ — намного больше: несколько сот тысяч, относящихся к неорганическим, и несколько миллионов органических.
Курс химии, изучаемый в средней школе, можно разделить на три основные части: общую, неорганическую и органическую химию. Общая химия рассматривает основные химические понятия, а также важнейшие закономерности, связанные с химическими превращениями. Этот раздел включает основы из различных разделов современной науки: «физической химии, химической кинетики, электрохимии, структурной химии и др.
Неорганическая химия изучает свойства и превращения неорганических (минеральных) веществ. Органическая химия изучает свойства и превращения органических веществ.
Химия и медицина
Разработки химиков применяются для нужд медицины ещё с древних времен. Так, исследования соединений ртути и мышьяка Парацельсом легли в основу ятрохимии – науки о применении определенных химических соединений для лечения болезней. Открытие веществ, способных уничтожать в окружающей среде различных микробов легло в основуметода дезинфекции. Так, для дезинфекции тканей во время операций Д. Листер применял растворы фенола; П. Кох — растворы хлорной ртути, а в 1909 году Стреттон открыл дезинфицирующие свойства растворов йода в спирте.
|
|
|
Успешно проведенный П. Эрлихом синтез соединения на основе мышьяка заложил основы химиотерапии – методе лечения какого-либо инфекционного, паразитарного заболевания или злокачественной опухоли(рака) с помощью ядов или токсинов.
Ещё одним важным открытием химиков для медицины стал синтез различных сывороток, позволяющих выработать иммунитет к конкретному заболеванию.
Большую роль играет химия в развитии фармацевтической промышленности: основную часть всех лекарственных препаратов получают синтетическим путем.
Химический органический синтез – основа фармацевтической промышленности (производство лекарств). Источниками для синтеза лекарственных препаратов служат неорганическое (горные породы, руды, газы, морская и озерная вода) и органическое сырье (древесина, травы, нефть, природный газ).
Существует две классификации лекарственных препаратов – фармацевтическая, которую используют в медицинской практике и химическая, применяемая в области синтеза лекарственных препаратов.
|
|
|
Особое место в фармацевтической промышленности занимает производство болеутоляющих антибактериальных и химиотерапевтических средств, витаминов и гормонов.
Болеутоляющие средства
Эти вещества характеризуются несколькими типами действия – обезболивающим, противовоспалительным и жаропонижающим. По химической структуре эти вещества можно разделить на производные салициловой кислоты (аспирин, салицилат натрия и др.) и пиразолона (амидопирин, антипирин, анальгин, бутадион).
Снотворные средства
В своем большинстве снотворные средства представляют собой производные барбитуровой кислоты, хотя сама кислота снотворного действия не оказывает. По механизму влияния на центральную нервную систему их относят к наркотическим веществам.
Антибактериальные и химиотерапевтические средства
К этой группе лекарственных препаратов относят антисептики и дезинфицирующих средства. Это, в первую очередь сульфаниламидные препараты (сульфадимезин, сульфазин, норсульфазол, этазол и др.) и антибиотики.
Благодаря химии научились выделять витаминные препараты. Витамины — группа низкомолекулярных органических соединений, характеризующихся простотой химического строения и разнообразием химической природы. Изучение витаминов открыло возможность для понимания механизма действия лекарственных веществ, а также сыграло значительную роль в развитии химиотерапии.Витамины содержатся в продуктах питания, либо могут быть получены путем химического синтеза.
|
|
|
Клиническая химия – это раздел клинической лабораторной диагностики, предметом которого является изучение и оценка химического состава тканей, биологических жидкостей для выявления отклонений от нормы и установления диагноза. Клинические лабораторные исследования в динамике помогают выявить работу отдельных органов и систем, проследить за течением болезненного процесса.
Методы клинической химии широко применяются в диагностике заболеваний внутренних органов в т.ч. воспалительного характера, онкологических, эндокринных, инфекционных заболеваний. Большое значение они имеют в процессе предоперационного обследования больных и контроля течения послеоперационного периода.
Использование полимеров в медицине
Количество полимерных материалов, используемых в медицине, постоянно расширяется. Широкое применение нашли полиэтилен низкого давления, пенополиуретан, полипропилен, эпоксидные, полиэфирные и кремнийорганические полимеры, а также специальные клеи, которые при хирургическом вмешательстве могут склеивать ткани, заменяя шовный материал. Производство резины из каучука также нашло применение в медицине, начиная от резиновой грелки до специальной резиновой надувной кровати для больных с обширными ожогами.
Важным аспектом использования полимеров в медицине является их применение для изготовления заменителей крови, а также в хирургии для замены отдельных костей при переломах скелета, ребер,черепной коробки, для изготовления зубных протезов,кровеносных сосудов, искусственных почек, сердечных клапанов и т. д.
Шланги, изготовленные из поливинилхлорида, применяют при переливании крови, а из пластмасс изготовляют перевязочные материалы, сухожилия и глазные протезы.
2. Атомно-молекулярное учение. Атомы и молекулы. Относительная атомная и молекулярная масса. Моль – единица количества вещества. Молярная масса 

 3. Химический элемент, простое и сложное вещество, смесь веществ. Понятие об аллотропных модификациях. Химические знаки. формулы и уравнения.
3. Химический элемент, простое и сложное вещество, смесь веществ. Понятие об аллотропных модификациях. Химические знаки. формулы и уравнения.
Химический элемент — определенный вид атомов с одинаковым положительным зарядом ядра. Известно 107 элементов. Все элементы обычно делят на металлы и неметаллы.
Классификация веществ. Все вещества подразделяются на смеси и чистые вещества. Смеси состоят из нескольких веществ, каждое из которых сохраняет свои индивидуальные свойства и может быть выделено в чистом виде.
Смеси могут быть гомогенными (однородными) и гетерогенными (неоднородными). Примером гомогенной смеси могут служить растворы, гетерогенной — бетон, смесь сахара и соли и т.д.Для получения чистых хим веществ используются различные хим и физические методы очистки. Однако на практике любое вещество содержит какое-то количество примесей. При высокой степени очистки содержание последних настолько мало, что практически не влияет на химические и физические свойства веществ. Химические вещества подразделяются на простые и сложные. Простые вещества — это вещества, образованные из атомов одного элемента. Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота.
Сложные вещества, или хим соединения, — это вещества, образованные атомами разных элементов.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурами плавления и кипения и т.п. Эти свойства относятся к совокупности атомов и для разных простых веществ они различны. Хим элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером), степенью окисления, изотопным составом и т.д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода — озон).
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор. Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле (например, кислород О 2 и озон Оз. 2)и различной кристаллической структурой образующихся модификаций, например олово серое и белое.
Химические знаки, формулы и уравнения. Элементы принято обозначать химическими знаками (символами). Символ элемента состоит из первой буквы или первой и одной из следующих букв латинского названия элемента; первая буква всегда прописная, вторая — строчная. Например, латинское название водорода Hydrogenium, обозначение — Н, кислорода — Oxygenium — О. Состав сложных веществ изображается при помощи химических формул. Например, формула H2S04 показывает, что это серная кислота; 1 моль ее образован из 2 моль атомов водорода, 1 моль атомов серы и 4 моль атомов кислорода. Формулами обозначаются и молекулы простых веществ, если известно, из скольких атомов состоит молекула. Например, Н2, О2,F2. Однако если простое вещество имеет атомную или металлическую структуру или неизвестен атомный состав молекулы, то его изображают химическим знаком элемента. Например, Не, А1, С. Хим формулу вещества можно установить по результатам анализа его состава
Химические уравнения записывают с помощью хим формул и знаков. Они служат для изображения хим реакций и отражают закон сохранения массы веществ. В каждом уравнении имеется две части, соединенные знаком равенства. В левой части записывают формулы веществ, вступающих в реакцию, в правой —формулы веществ, образующихся в результате реакции. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Составим, например, уравнение реакции взаимодействия хлорида железа (111) с гидроксидом натрия.
Запишем схему этой реакции, т.е. формулы исходных и конечных веществ реакции, указав стрелкой ее направление: FeCI 3 + NaOH ->Fе(ОН)з + NaCI Чтобы уравнять число атомов железа, натрия, хлора, кислорода и водорода в левой и правой частях уравнения, надо перед формулами NaCl и NaOH поставить коэффициент 3: FeCl3 + 3NaOH = Fе(ОН)3+ 3NaCl В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой. Это означает, что это уравнение удовлетворяет закону сохранения массы веществ , следовательно, написано правильно. Коэффициенты перед формулами веществ в уравнениях хим реакций называют стехиометрическими коэффициентами. Коэффициенты в обеих частях хим уравнения можно увеличивать или уменьшать в одно и то же число раз. Так, если уравнивать коэффициенты, исходя из одного моля гидроксида натрия, то уравнение примет вид1/3 FeCI + NaOH = 1/3Fе(ОН)з + NaCI В этом случае оно также будет правильным, так как соблюдается закон сохранения массы веществ. Коэффициент 1 обычно опускается. Подбор коэффициентов в химическом уравнении осуществляется с помощью простых рассуждений после того, как записана схема реакции.По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.Массовая доля элемента в данном веществе — это отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:

где (X) — массовая доля элемента X; А r (X) — относительная атомная масса элемента X; n — число атомов элемента Х в молекуле вещества; Mr — относительная молекулярная масса вещества Массовые доли обычно выражают в процентах:
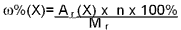
Например, рассчитаем массовые доли водорода и кислорода в Н 2О:

Аллотропные модификации
На сегодняшний день насчитывается больше четырехсот аллотропных модификаций простых веществ. К примеру, алмаз и графит – это аллотропные модификации углерода, хотя эти вещества внешне совершенно непохожи. У графита структура гексагональная слоистая, а у алмаза выглядит как правильно соединенная с друг другом сетка тетраэдрических образований.
Иногда это явление объединяют с полиморфизмом. Это возможность веществ твердого агрегатного состояния находится в двух или больше видоизменениях с различной кристаллическим построением и свойствами при одинаковом химическом составе. Но аллотропия имеет отношение лишь к простым веществам, вне зависимости от их агрегатного состояния, а полиморфизм — к любому твердому вещество, без указания на то, простое оно или сложное.Несмотря на количество аллотропных модификаций у химического элемента, самым стойким и не разрушающимся оказывается, в большинстве, только одно. Вот примеры одних из самых распространенных примеров аллотропии веществ: углеродможет образовать множество аллотропных модификаций — алмаз, графит, карбин и т.д. Кремний образует два аллотропных видоизменения: аморфный и кристаллический кремний
Разнообразие сложных веществ наблюдается из-за их разного количественного состава. Его можно определить по набору электронов, находящихся на электронном уровне атома и количественное содержание протонов и нейтронов в ядре. Но было обнаружено, что химические элементы могут образовывать различные вариации, у которых у ядер один и тот же заряд, но при этом у них разные массы. Такие разновидности атомов называются изотопами. Явления аллотропии и изотопии являются подтверждениями многообразия неорганических веществ.
Основные законы химии. Закон сохранения массы вещества, его значение в химии. Закон постоянства состава вещества. Закон Авогадро и его следствия. Число Авогадро.


Периодическая система химических элементов – таблица Менделеева
В 1869 г. русский ученый Дмитрий Иванович Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Менделеев назвал эту таблицу “Система элементов”. Проанализировав изменение физико-химических свойств в Системе элементов, Менделеев сформулировал фундаментальный закон природы – закон периодичности.
Дата добавления: 2018-05-12; просмотров: 869; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
