Материальный баланс и тепловые балансы процессов изотермической и изогидравлической кристаллизации.
Материальный баланс кристаллизации
Кристаллизация с удалением части растворителя. Обозначим:
Gp, Gкр, Gм — количества исходного раствора, полученных кристаллов и маточного раствора, кг;
bp, bм — концентрации исходного и маточного растворов, вес. доли;
а = М/Мкр — отношение молекулярных весов абсолютно сухого растворенного вещества и кристаллосольвата (для водного раствора кристаллогидрата); при кристаллизации без присоединения молекул растворителя М = Мкр и а = 1;
W — количество удаленного растворителя, кг.
Тогда общий баланс будет:
Gр = Gкр + Gм + W
Баланс по абсолютно сухому растворенному веществу:
Gр bр = Gкр*a + Gм bм
Весовое количество полученных кристаллов определяется совместным решением уравнений.
Gкр= 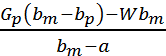
При испарении растворителя в газ (воздух) расход газа (в кг) определяется из уравнения
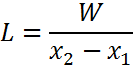
где L — расход сухого газа (воздуха), кг; х1 х2 — начальное и конечное влагосодержание газа (воздуха).
Тепловой баланс непрерывной кристаллизации
При растворении твердого кристаллического вещества происходит поглощение тепла qкp для разрушения кристаллической решетки (теплота плавления) и выделение тепла при химическом взаимодействии вещества с растворителем qp (образование гидратов). В зависимости от величин qкp и qp тепловой эффект кристаллизации будет положительным или отрицательным.
Помимо принятых в материальном балансе введем следующие обозначения: iр, iкр, iм — энтальпия раствора, кристаллов и маточного раствора, кдж/кг; iт1, iт2 — начальная и конечная энтальпия теплоносителя, кдж/кг; i01, io2 — начальная и конечная энтальпия охлаждающей среды, кдж/кг; I — энтальпия парообразного растворителя, кдж/кг; r — теплота образования кристаллической решетки (теплота затвердевания), кдж/кг кристаллов; Δq— тепловой эффект концентрирования раствора при изменении его концентрации от bр до bм кдж; GT, G0 — количество теплоносителя или охлаждающей среды, кг/сек.
В общем случае будем иметь:
Приход тепла:
С раствором Gр*iр = Q1
Теплота кристаллизации Gкр*r = Q2
Теплота дегидратации ±ΔqGм bм = Q3
Получено от теплоносителя Gт (iт1 – iт2 ) =Q4
Расход тепла:
С кристаллами Gкр iкр = Q5
маточным раствором Gм iм = Q6
С парами растворителя WI = Q7
охлаждающим агентом Go(i02- i01) = Q8
Потери в окружающую среду Q9
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 + Q6 + Q7 ± Q9
Энтальпии iр, iкр, iм рассчитывают (в кдж/кг) по уравнению общего вида
i = с (t2 — t1)
Экстрагирование. Назначение, движущая сила и физическая сущность процесса. Статика и кинетика процесса экстрагирование. Определение средней движущей силы процесса, расчет удельного расхода поглотителя.
Экстракцией в широком смысле называют процессы извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов). При взаимодействии с экстрагентом в нем хорошо растворяются только извлекаемые компоненты и значительно слабее или практически вовсе не растворяются остальные компоненты исходной смеси.
В химической технологии экстракция из растворов экстрагентами более распространена, чем экстракция из твердых тел. Экстракция из твердых веществ или квазитвердых материалов (например, из тканей растительного сырья) применяется главным образом в лесохимической, пищевой и фармацевтической промышленности. В химической технологии используют в основном экстракцию из твердых пористых веществ водой или водными растворами кислот и щелочей (процессы выщелачивания)
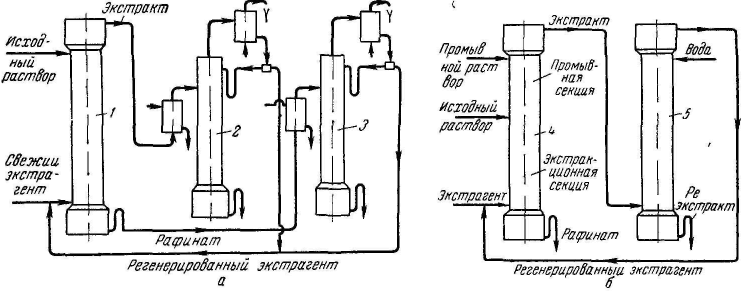
В зависимости от вида контакта между жидкими фазами экстракторы, как и другие массообменные аппараты, бывают: 1) ступенчатые, где изменение состава фаз происходит скачкообразно, от ступени к ступени, из которых состоит аппарат; 2) дифференциально-контактные, в которых изменение состава фаз приближается к непрерывному.
Кинетика процесса экстракции (кинетические закономерности) определяются основными законами массопередачи. В процессе происходит взаимодействие капель дисперсной фазы и дисперсионной среды. При этом основными стадиями этого процесса являются: переход распределяемого вещества из среды к поверхности капли, а затем внутрь нее или, наоборот, из капли через поверхность раздела фаз в ядро потока среды.
В этом случае коэффициент массопередачи Кх может быть принят равным коэффициенту массоотдачи среды βс, т. е. Кх ≈ βс, а количество переданного вещества определяется из соотношения
М = βс*Δхср*F
Коэффициент массоотдачи для этого случая рассчитывается по критериальному уравнению
Nuдиф.с = βс*d/Dдиф.с = f*(Peдиф.с),
где Nuдиф.с – диффузионный критерий Нуссельта для среды; Dдиф.с – коэффициент диффузии распределяемого вещества в среде; d — диаметр капли; Peдиф.с = wd/Dдиф.с - диффузионное число Пекле для среды; w —относительная скорость движения капли исреды.
2. Диффузионное сопротивление сосредоточено в дисперсной фазе (капля).
Коэффициент массопередачи Ку может быть принят равным коэффициенту массоотдачи дисперсной фазы βдисп, т. е. Ку≈ βдисп, а количество переданного вещества определяется из соотношения
М = βдисп*Δуср* F
Коэффициент массоотдачи для этого случая определяется из уравнения
Nuдиф.д = βс*d/Dдиф.д = f*(Peдиф.д),
где Nuдиф.д – диффузионный критерий Нуссельта для дисперсной фазы; Dдиф.д – коэффициент диффузии распределяемого вещества в капле; Peдиф.д = wd/Dдиф.д – диффузионное число Пекле для капли.
Диффузионные сопротивления в среде и капле соизмеримы.
В этом случае количество переданного вещества определяется в соответствии с основным уравнением массопередачи, а коэффициенты массопередачи рассчитываются по выражениям.
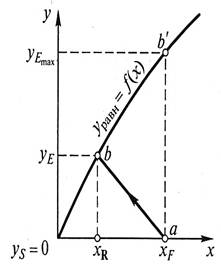
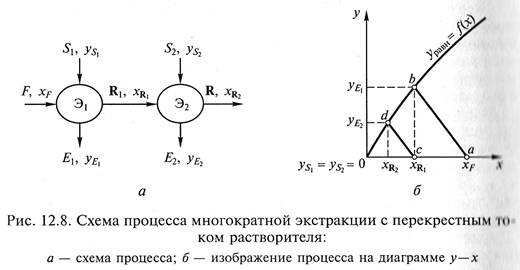

Движущей силой процессов экстракции жидкостью из твердых материалов является разность между концентрацией растворяющегося вещества у поверхности твердого тела с р и его средней концентрацией Сд в основной массе раствора.
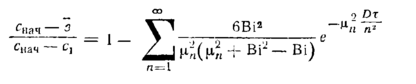
При критерии Bi=1
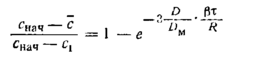
Где 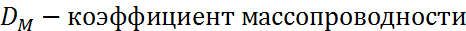

Дата добавления: 2018-05-02; просмотров: 512; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
