Адсорбция на границе раздела: твердое тело - газ (жидкость). Уравнение и теория Ленгмюра. Уравнение Фрейндлиха.
Процесс накопления (повышения концентрации) какого-либо вещества на поверхности другого называется адсорбцией.
Вещество, на поверхности которого идет адсорбция называется адсорбентом. Вещество, которое накапливается на поверхности – адсорбат. В качестве адсорбентов используют высокопористые материалы: активированные угли, силикагель, пористые полимерные смолы.
Процесс накопления одного вещества в объеме другого называется абсорбцией.
Процесс, обратный адсорбции – десорбция.
Количественной характеристикой адсорбции является удельная адсорбция (Г).
Величина Г численно равна количеству вещества, которое поглощается единицей площади адсорбента:
 , [моль/м2];
, [моль/м2];
В случае адсорбции на твердом адсорбенте Г равно количеству вещества, которое поглощается единицей массы адсорбента:
 , [моль/кг].
, [моль/кг].
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента.
3) Активные центры эквивалентны.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается равновесие.
Уравнение Ленгмюра:
|
|
|
 ,
,
где С – концентрация адсорбата, В – некоторая постоянная,  - максимальная адсорбция.
- максимальная адсорбция.
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
При средних значениях концентрации для описания процесса адсорбции можно использовать уравнение Фрейндлиха.
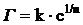 .
.
В логарифмической форме:
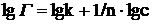 .
.
Адсорбция на границе раздела жидкость - газ, жидкость - жидкость. Уравнение Гиббса, его анализ.
Адсорбция на границе жидкость – газ описывается уравнением Гиббса:
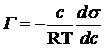 ,
,
где 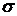 - поверхностное натяжение, с – концентрация растворенного вещества.
- поверхностное натяжение, с – концентрация растворенного вещества.
Величину g = –dσ/dС называют также поверхностной активностью растворенного вещества.
В зависимости от влияния концентрации на поверхностное натяжение σ все вещества делятся на 3 группы:
1. Вещества, добавление которых увеличивает поверхностное натяжение – поверхностно-инактивные (ПИАВ).
|
|
|
g = –dσ/dС>0; Г < 0. Отрицательная адсорбция означает, что концентрация вещества в поверхностном слое меньше по сравнению с его концентрацией в объеме раствора. К ПИАВ относятся неорганические кислоты, щелочи, соли.
2. 1. Вещества, добавление которых не изменяет поверхностное натяжение – поверхностно-неактивные (ПНВ).
g = –dσ/dС=0; Г = 0. Концентрация вещества на поверхности равна концентрации в объеме.
3. Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ).
g = –dσ/dС < 0; Г > 0.
В результате адсорбции ПАВ на поверхности раздела жидкость – пар, концентрация вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.
К ПАВ относятся карбоновые кислоты, жиры, амины, спирты и т. д.
|
|
|

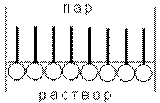
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу (кружок), так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое происходит следующим образом:
Дата добавления: 2018-05-02; просмотров: 577; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
