Влияние температуры на скорость реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
Правило Вант-Гоффа:
Скорость реакции с повышением температуры на каждые 10 °C в увеличивается в 2 – 4 раза.
 , где
, где 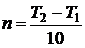 ,
, 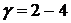 .
.
Более точно зависимость константы скорости от температуры выражается уравнением Аррениуса:
1. 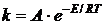 ,
,
или
2.  ;
;
где А – константа, Е – энергия активации.
Энергия активации Е – это та минимальная избыточная энергия (по сравнению со средней энергией молекул), необходимая для того, чтобы молекула вступила в химическую реакцию. Так как не любое столкновение молекул ведет к образованию новой молекулы, т. е. к протеканию химической реакции, химическое взаимодействие происходит только между активными молекулами, обладающими энергией, равной или большей энергии активации E. Чем меньше E, тем больше скорость реакции.
Влияние катализатора на скорость реакции. Гомогенный, гетерогенный и ферментативный катализ.
Катализаторами называют вещества, которые изменяют скорость реакции, но сами при этом не расходуются.
Различают гомогенный, гетерогенный и ферментативный катализ. Если во время реакции вещества находятся в одной фазе, то катализ называется гомогенным, если в различных, то – гетерогенным. Катализ, протекающий под действием ферментов, называется ферментативным.
Пример:
1) 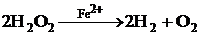 – гомогенный катализ;
– гомогенный катализ;
2) 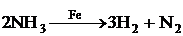 – гетерогенный катализ;
– гетерогенный катализ;
3)  – ферментативный катализ.
– ферментативный катализ.
Каталитические реакции характеризуются следующими особенностями:
|
|
|
1) катализатор не расходуется в ходе реакции, количество его остается постоянным;
2) он не изменяется химически в ходе реакции;
3) малое количество катализатора (по сравнению с объёмом реагирующего вещества) значительно меняет скорость реакции;
4) действие его специфично, однако существуют катализаторы, ускоряющие многие реакции, например Pt, Ni при гетерогенном катализе, ионы H+ в гомогенном катализе;
5) участвуя в реакции, он не смещает химического равновесия, а в одинаковой мере изменяет скорости прямой и обратной реакций.
Посторонние вещества по отношению к катализатору могут быть инертными, усиливать его действие (промоторы) или ослаблять (каталитические яды). Увеличение скорости реакции под влиянием катализатора связано, как правило, с уменьшением энергии активации реакции.
Электропроводность растворов. Удельная электропроводность и факторы, от которых она зависит.
Электролиты – вещества, растворы или расплавы которых обладают ионной проводимостью. По сравнению с металлами (сплавами металлов), проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода. Проводники второго рода – это растворы кислот и оснований, расплавы и растворы солей. Так как все биологические жидкости и ткани организма обладают ионной проводимостью, то они относятся к растворам электролитов.
|
|
|
Важным свойством растворов электролитов является электрическая проводимость (электропроводность), которая характеризует их способность проводить электрический ток.
Различают удельную, эквивалентную и молярную электропроводность. Величина, обратная удельному сопротивлению (r), называется удельной электропроводностью (k, «каппа»).
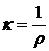 ; [Ом-1 м-1]
; [Ом-1 м-1]
Удельная электропроводность, это электропроводность раствора электролита, помещенного между параллельными электродами площадью 1 м2, находящимися на расстоянии 1 м.

1. раствор электролита
2. электроды
Электропроводность растворов зависит от:
1.природы растворителя,
2. вязкости
3. температуры среды,
4. радиуса ионов,
5. концентрации ионов в растворе.
При увеличении концентрации удельная электропроводность сначала растет, а затем уменьшается.
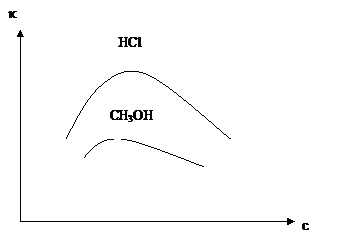
Рис. Зависимость удельной электропроводности от концентрации
Удельная электропроводность растет при увеличении температуры, уменьшении вязкости и уменьшения радиуса иона в растворе.
|
|
|
Дата добавления: 2018-05-02; просмотров: 441; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
