Классификация окислительно-восстановительных реакций
Все окислительно-восстановительные реакции разделяются на три группы:
1. Реакции межмолекулярного окисления-восстановления, в которых окислитель и восстановитель находятся в разных веществах, причём эти вещества могут быть как сложными, так и простыми:
H2SO3 + 2H2S = 3S + 3H2O
2. Внутримолекулярные окислительно-восстановительные реакции, в которых происходит изменение степеней окисления атомов в одной и той же молекуле. В этом случае атом с более положительной степенью окисления будет окислять другой атом с меньшей степенью окисления. Например, к ним относятся реакции термического разложения:
NH4NO2 = N2 + 2H2O
3. Реакции диспропорционирования (дисмутации), или самоокисления – самовосстановления. Протекание таких реакций сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента (по сравнению с первоначальным). Очевидно, реакции диспропорционирования возможны для веществ, содержащих атомы с промежуточной степенью окисления:
4KCℓO3 = 3KCℓO4 + KCℓ
Эквивалентные массы окислителя и восстановителя
Эквивалентная масса окислителя- это отношение молярной массы окислителя к количеству электронов, принятых одним молем окислителя. Эквивалентная масса восстановителя - это отношение молярной массы восстановителя к числу потерянных электронов одним молем восстановителя.
Пример. Сколько граммов FeSO4можно окислить в присутствии серной кислоты 0,25 н раствором K2Cr2O7 объёмом 100 см3?
|
|
|
Решение. Уравнение протекающей реакции
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
2Fe+2 – 2e ® 2Fe+3 3
2Cr+6 + 6e ® 2Cr+3 1
Число эквивалентных масс K2Cr2O7 в 100 см3 раствора:
n = 0,25×100/1000 = 0,025 моль-экв.
Вещества реагируют между собой согласно закону эквивалентов, поэтому с 0,025 моль-экв. K2Cr2O7 должно прореагировать такое же количество моль-экв. FeSO4. Fe+2 теряет один электрон и переходит в Fe+3, следовательно, эквивалентная масса FeSO4 равна его мольной массе 152 г/ моль, а искомая масса m( 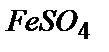 ) = 152×0,025 = 3,8 г.
) = 152×0,025 = 3,8 г.
Дата добавления: 2018-04-15; просмотров: 147; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
