Окислительно-восстановительных реакций
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) играют большую роль в природе и технике. Они являются основой жизнедеятельности. С ними связано дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических элементах, аккумуляторах и топливных элементах.
Основные понятия
Все химические реакции можно разделить на два типа:
1. Реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
2. Реакции, идущие с изменением степени окисления атомов реагирующих веществ.
Степень окисления (окислительное число) характеризует состояние атома в молекуле.
Степень окисления элемента – условный электрический заряд атома (иона), который приобретает атом (ион) в результате смещения электронной плотности от менее электроотрицательного атома (иона) к более электроотрицательному атому (иону). Если молекула образована одним и тем же атомом (H2, Cl2), то электронная плотность распределена равномерно и степень окисления равна нулю.
|
|
|
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:
1. Степени окисления элементов в простых веществах принимаются равными нулю (Znо, Feо, Cdо, О2о, N2о); Это положение показывает формальное отображение валентности элемента в соединении. Валентность показывает количество связей, образуемых данным атомом с другими атомами. В молекуле водорода между атомами существует одинарная связь, валентность равна 1, а степень окисления = 0. В молекуле азота между атомами тройная связь, валентность = 3, а степень окисления = 0. Степень окисления и валентность совпадают между собой и равны 0 у благородных газов.
2. В сложных соединениях некоторые элементы проявляют одну и ту же степень окисления, но для большинства элементов она переменна.
Постоянную степень окисления в соединениях имеют:
а) щелочные металлы: +1;
б) металлы главной подгруппы II группы, цинк, кадмий: +2;
в) водород проявляет степень окисления +1 во всех соединениях, кроме гидридов металлов (NaH-1, CaH2-1 и др.), где степень окисления его равна –1;
г) степень окисления кислорода в соединениях равна –2, за исключением пероксидов (-1) и фторида кислорода OF2 (+2).
|
|
|
3. Для элементов с непостоянной степенью окисления (С/О) ее значение рассчитывают исходя из того, что алгебраическая сумма степеней окисления всех атомов, входящих в состав молекул, равна нулю.
Определим в качестве примера С/О углерода в соединениях: СО, СО2, СН4, С2Н6, С2Н5ОН. С/О(Н) = +1, С/О(О) = –2. Обозначим С/О (С) за «х»:
СО х – 2 = 0 Þ х = + 2
СО2 х + 2(– 2) = 0 Þ х = + 4
СН4 х + 4( +1) = 0 Þ х = – 4
С2Н6 2х + 6( +1) = 0 Þ х = – 3
С2Н5ОН 2х + 6( +1) – 2 = 0 Þ х = + 4
Т.о., мы подошли к определению ОВР.
ОВР – это реакции, в результате которых изменяются С/О элементов. ОВР – это реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате смещения электронной плотности от атома одного из реагентов (восстановителя) к атомам другого реагента (окислителя).
Не ОВР: HCl + NaOH = NaCl + H2O
ОВР: 2Na + Cl2 = 2NaCl
Na0 – e = Na+ ( процесс окисления)
Процесс окисления – это процесс отдачи электронов, сопровождающийся увеличением С/О элемента.
Cl0 + e = Cl- (процесс восстановления)
Процесс восстановления – это процесс принятия электронов, сопровождающийся уменьшением С/О элемента.
|
|
|
Вещество (атом, молекула, ион), отдающее электроны, называется восстановителем. В процессе ОВР восстановитель окисляется.
Вещество (атом, молекула, ион), принимающее электроны, называется окислителем. В процессе ОВР окислитель восстанавливается.
Число отданных и принятых электронов в ходе ОВР одинаково, т.е. одновременно протекают реакции окисления и восстановления.
Восстановителями могут быть:
1. Нейтральные атомы металлов и некоторые неметаллы (Znо, Mgо, Cо и др.)
2. Отрицательно заряженные ионы неметаллов (S-2, J-,…);
3. Положительно заряженные ионы металлов с низшей степенью окисления (Sn+2,Pb+2);
4. Сложные кислородосодержащие ионы с низшей степенью окисления ( 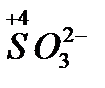 ,
, 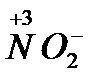 );
);
5. Катод.
Наиболее употребляемыми восстановителями на практике являются: C, CO, H2 , Zn, Ca, Mg, Al, Fe, H2S, Na2S, Na2S2O3, HI, HBr, HCl и др.
Окислителями могут быть:
1. Нейтральные молекулы неметаллов (О20, О30, Cl20…);
2.Положительно заряженные ионы металлов в высшей степени окисления ( 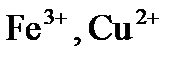 …);
…);
3.Сложные кислородосодержащие ионы в высшей степени окисления кислородообразующего элемента ( 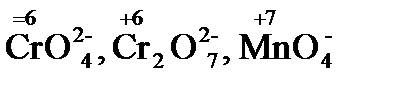 …);
…);
4. Анод.
В качестве окислителей на практике чаще используют: O2, Cl2, Br2, J2, O3, KMnO4, K2CrO4, K2Cr2O7, HNO3, H2SO4(к), и др.
|
|
|
Вещества, в которых элемент имеет промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства ( 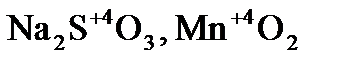 ,…).
,…).
Как правило, в кислотах элементом-окислителем является катион водорода, т.е. процесс восстановления выглядит так:
2Н+ + е = Н2 (НCl, разб. H2SO4)
Однако в концентрированной серной кислоте окислителем является S+6. Поэтому концентрированная серная кислота реагирует с активными и неактивными металлами, неметаллами и сложными веществами, восстанавливаясь при этом до Н2S, S и SO2. Состав продуктов восстановления определяется активностью восстановителя, концентрацией кислоты и температурой системы. Чем активнее восстановитель и выше концентрация кислоты, тем более глубоко протекает восстановление.
Пример.
Активный металл +H2SO4 (конц) ® MeSO4 + S (H2S) + H2O
восстановитель окислитель
3Zn + H2SO4(конц.) + 3H2SO4 = 3ZnSO4 + S + 4H2O
Znо – 2e = Zn+2 4 процесс окисления
S+6 + 8e = S-2 1 процесс восстановления
4Mg + H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
Mgо – 2e = Mg+2 4 процесс окисления
S+6 + 8e = S-2 1 процесс восстановления
Малоактивные металлы, а также бромоводород и некоторые неметаллы восстанавливают концентрированную серную кислоту до SO2
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Cuо – 2e = Cu+2 1 процесс окисления
S+6 + 2e = S+4 1 процесс восстановления
2HBr + H2SO4(конц.) = Br2 + SO2 + 2H2O
2Br- – 2e = Br2o 1 процесс окисления
S+6 + 2e = S+4 1 процесс восстановления
C(уголь) + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O
Cо – 4e = C+4 1 процесс окисления
S+6 + 2e = S+4 2 процесс восстановления
Азотная кислота, как правило, является окислителем за счет N5+, а H+ не принимает участие в окислительно-восстановительных реакциях, поэтому из азотной кислоты металлы не вытесняют молекулярный водород. Окислительная способность HNO3 усиливается с ростом её концентрации. При взаимодействии HNO3 с металлами образуются нитраты соответствующих металлов. Состав остальных продуктов восстановления HNO3 зависит от активности восстановителя и концентрации кислоты, чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление N+5 в HNO3:
увеличение концентрация кислоты
NO2 NO N2O N2 NH4+
увеличение активность восстановителя
При действии сильно разбавленной азотной кислоты на активные металлы образуется нитрат аммония
Активный металл + HNO3(P) нитрат + NH4NO3 + H2O
восстановитель окислитель
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
Caо– 2e = Ca+2 4 процесс окисления
N+5+ 8e = N-3 1 процесс восстановления
При действии разбавленной азотной кислоты на малоактивные металлы может выделяться оксид азота(II)
Малоактивный металл + HNO3(P) нитрат + NO + H2O
восстановитель окислитель
3Ag + 4HNO3(P) = 3AgNO3 + NO + 2H2O
Agо – 1e = Ag+ 3 процесс окисления
N+5 + 3e = N+2 1 процесс восстановления
а в случае активных металлов – оксид азота(I) или свободный азот
Активный металл + HNO3(P) нитрат + N2O (N2) + H2O
восстановитель окислитель
5Mg + 12HNO3 = 5Mg(NO3)2 + N2 + 6H2O
Mgо– 2e = Mg+2 4 процесс окисления
N+5 + 8e = N-3 1 процесс восстановления
При действии концентрированной азотной кислоты на активные металлы образуется оксид азота(I)
Активный металл + HNO3(конц) нитрат + N2O + H2O
восстановитель окислитель
8Aℓ + 30HNO3 = 8Aℓ(NO3)3 + 3N2O + 15H2O
Aℓо– 3e = Aℓ+3 8 процесс окисления
2N+5+ 8e = N+1 3 процесс восстановления
а в случае малоактивных металлов образуется оксид азота(IV)
Малоактивный металл + HNO3(окнц) нитрат + NO2 + H2O
восстановитель окислитель
Ag + 2HNO3 = AgNO3 + NO2 + H2O
Аgо– 2e = Ca+2 4 процесс окисления
N+5+ 8e = N-3 1 процесс восстановления
С неметаллами HNO3 восстанавливается чаще до NO или NO2(реже).
3P + 5HNO3(P) + 2H2O = 3H3PO4 + 5NO
Pо – 5e = P+5 3 процесс окисления
N+5 + 3e = N+2 5 процесс восстановления
Методы составления уравнений
окислительно-восстановительных реакций
Основным методом составления ОВР является метод электронного баланса. В его основе лежит правило: «Число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции». Порядок действий по этому методу:
1) определить С/О элементов, найти изменяющиеся;
2) составить электронный баланс, записать окисляющиеся и восстанавливающиеся элементы, количество присоединенных и отданных электронов;
3) уравнять число отданных и принятых электронов;
4) полученные коэффициенты расставить перед окислителем и восстановителем в левой части уравнения и перед продуктами их восстановления и окисления – в правой части уравнения;
5) уравнять ионы металла, не изменяющие своей С/О, а участвующие в связывании анионов среды;
6) расставить коэффициенты перед средой;
7) уравнять число атомов (Н) и (О).
Пример:
H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O
восстановитель окислитель среда
Расставим коэффициенты в уравнении реакции методом электр. баланса.
2Cr+6 + 6e = 2Cr+3 1 процесс восстановления
S -2 – 2e = Sо 3 процесс окисления
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
Дата добавления: 2018-04-15; просмотров: 261; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
