Прежде чем перейти к рассмотрению активного транспорта, остановимся на механизмах прохождения ионов через мембрану.
Каналы.
Биологическая мембрана содержит йонные каналы. представляющие собой липопротеиновые комплексы сложной структуры. В узких каналах (натриевый З,1х5,1 Ǻ, калиевый 4,5х4,5 Ǻ) возможно однорядное движение ионов, которые могут взаимодействовать друг с другом и с молекулярными группами канала. При поступлении йона в канал происходит замещение молекул воды гидратной оболочки йона на полярные группы полости канала. Увеличение свободной энергии йона при дегитрации с избытком компенсируется энергией его взаимодействия с полярными группами канала. В результате общая энергия иона снижается, что и облегчает его прохождение через канал.Наличие полярных групп, а также фиксированных анионных центров в канале приводит за счет их кулоновских взаимодействий с ионом к снижению энергетического барьера перехода йона из раствора в канал. Лучше всего проходят через канал ионы, которые прочно связываются электростатическими силами с анионным центром. Например, с небольшим отрицательным анионвым центром более прочно после потери гидратной оболочки будет связываться меньший по размеру катиов Nа+ по сравнению с катионом К+. В то же время радиус гидратированного йона Na+ больше, чем К+, и без потери гидратной оболочки ион Nа+ хуже проходит через относительно широкие поры в мембране. Наличие в канале фиксированных анионных центров, притягивающих катионы, облегчает их прохождение через канал, снижая энергию иона.На рис. 1 и 2 приведены энергетические профили Nа+ и К+ каналов. Скорость проведения Nа+ канала достигает 107 ионов/с. Через Nа+ канаа могут проходить и различные органические катионы размером не больше 3х5 Ǻ. В качестве анионного центра могут выступать атомы кислорода группы СОО. Калиевые каналы имеют широкое устье (>8 Ǻ) со стороны цитоплазмы, которое может блокироваться тетраэтиламмонием.
|
|
|
Однорядный транспорт ионов через канал обладает характерными особенностями. Ион относительно долго задерживается в каждой потенциальной яме. Это значит, что второй ион не может попасть в занятую потенциальную яму из-за электростатического взаимодействия (отталкивания) с уже находящимся там йоном. Перескоки между ямами совершаются под действием тепловых флуктуаций. Приложенное внешнее электрическое поле изменяет энергию иона и тем самым влияет на вероятность перескока. Выход из канала йона, связанного анионным центром, облегчается при появлении на входе канала другого йона вследствие их ион-ионного

| 
|
| Рис. 1. Энергетический профиль натриевого канала возбудимых мембран | Рис. 2. Энергетический профиль калиевого канала возбудимых мембран |
|
|
|
электростатического отталкивания. Проводимость канала зависит от того, насколько .заполнены участки входа» и «выхода» канала, связывающие йоны. При высоких концентрациях электролита оба участка связывания могут быть заполнены йонами, что приведет к блокировке канала и насыщению его проводимости. Ясно, что изменение числа частиц в канале изменяет и энергетический профиль канала вследствие кулоновских взаимодействий. Однако конформационные перестройки белка, формирующего йонный канал, могут также изменять высоту энергетического барьера в результате переориентации полярных, групп.
Переносчики.
Перенос йона через мембрану осуществляется также с помощью транспорта ионофоров (переносчиков). Йонофоры могут образовывать комплексы с ионом либо формировать поры в мембране, заполненные водой (каналы) - Закономерности этих процессов изучены на бислойных липидных мембранах. Энергия комплекса йон — переносчик значительно ниже энергии дегидратированного йона. Комплекс йонофора с йоном образуется на одной стороне мембраны, а затем перемещается на другую, где происходит освобождение йона и возвращение йонофора. Типичным подвижным переносчиком является валиномицин, который транспортирует К+. Катион калия входит во внутреннюю полость валиномицина, причем образовавшаяся структура стабилизируется за счет взаимодействия иона с 6—8 полярными группами СО (рис. 3), которые заменяют гидратную оболочку йона. Ион Nа+, обладающий меньшим радиусом, не в состоянии эффективно взаимодействовать с кислородами карбонильных групп. Молекула валиномицина переносит через ВЛМ ~104 ионов/с. Другой переносчик –
|
|
|
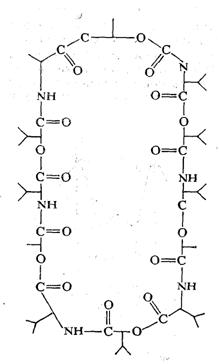
Рис. 3. Химическое строение молекулы валиномицина—ионофора
нигерицин – образует с йонами комплексы, в. которых молекула находится в свернутой конформации. Нигерицин может переносить и ионы Н+, являясь слабой кислотой. Он индуцирует в БЛМ и биологических мембранах обмен Н+ на К+. Молекула ионофора может образовывать комплекс, имеющий водную пору. Внешняя часть молекул в поре гидрофобна, а внутрь канала обращены хорошо поляризуемые группы. Наиболее известен как каналообразующий ионофор грамидицин. Молекула грамицидина А сформированная пятнадцатью гидрофобными аминокислотами, находясь в мембране, сворачивается в спиралевидную структуру. Она представляет собой полый цилиндр длиной около 30Ǻ и диаметром поры около 5—8 Ǻ. По такому каналу может переноситься около 107-108 ионов/с. При входе иона в грамицидиновьий канал происходит частичное замещение воды гидратной оболочки на карбонильные группы, обращенные внутрь поры. Ионные каналы обладают характерными флуктуациями проводимости вследствие их открывания и закрывания, что отличает канальную проводимость от транспорта с участием переносчиков. Анализ этих флуктуаций позволяет оценить среднее время жизни канала в открытом состоянии и проводимость одиночного канала. Очевидно, что при стохастическом характере открывания и закрывания канала значение его проводимости (g) колеблется около некоторого среднего значения (  ) со средним квадратичным отклонением, или дисперсией σ2
) со средним квадратичным отклонением, или дисперсией σ2
|
|
|
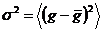
Напомним, что проводимость (g) канала для данного йона пропорциональна его проницаемости Р и концентрации С

Статистический анализ шумов процессов открывания – закрывания каналов показывает, что среднее значение проводимости мембраны связано с проводимостью (h0) ее одиночного канала простым соотношением

Отсюда можно определить значение h0 одиночного канала и τ0—время жизни канала в открытом состоянии, которое может варьировать от миллисекунд до секунд.
Активный транспорт.
Системы активного транспорта обеспечивают перенос ионов против градиента электрохимического потенциала и используют для этого энергию метаболизма - превращения аденозинтрифосфата (АТФ), сопряженные окислительно-восстановительные процессы.
Активный транспорт в нервных клетках осуществляется Na, К-АТФазой, локализованной в плазматических мембранах. Принцип действия Na, К-АТФазы состоит в том, что за счет освобождающейся при гидролизе АТФ энергии в ней происходят конформационные изменения, которые сопровождаются переносом ионов Nа из клетки во внеклеточную среду и одновременно К+ – в обратном направлении. На рис. 4 изображена схема функционирования Na, К-АТФазы, состоящей из двух полипептидных субъединиц (малой и большой).

Рис. 4. Схема функционирования К, Nа-АТФазы
На внутренней стороне мембраны в присутствии Nа и Мg-АТФ происходят фосфорилирование белка и образование комплекса NaЕ1~Р, в котором белок фермента Е находится в конформационно-напряженном состоянии, и переход его на внешнюю сторону мембраны. Затем дефосфорилирование белка на внешней стороне мембраны изменяет сродство фермента к йонам Nа+ и К+. Теперь йоны К+ лучше связываются с белком, ионы выходят во внешвюю среду, а фермент переходит в новое конформационное состояние (КЕ2), где у него высокое сродство к К+. Затем комплекс КЕ2 мигрирует во внутреннюю среду, где отщепляется К+, а фермент возвращается в исходное состояние Е1, теперь он вновь вступает в цикл превращений.
Стабильный фосфорилированный комплекс Е1 – Р связывает три иона Nа+ в состоянии Е2—два иона К+. Таким образом, энергия АТФ тратится на создание такого конформационного напряженного состояния комплекса NаE1 ~Р, где сродство к Nа+ понижается, а возрастает сродство к К+. Замена в этом состоянии 3Nа+ на 2К+ снимает напряжение. Таким образом, за счет энергии АТФ происходит упорядоченное изменение сродства йон-связывающих центров фермента к катионам. Смещение в мембране субъединиц, несущих йоны, осуществляется в результате тепловых колебаний. Высказывается предположение, что йон-связывающая ячейка фермента содержит координациюнную сферу с 12 атомами кислорода. Известно, что 4 атома кислорода могут образовывать Nа+ специфическую ячейку, а 6 атомов кислорода К+ специфическую ячейку. Перегруппировка этих 12 атомов кислорода из состояния, где связываются 3Nа+, 4 атома кислорода Х3 иона Nа+, в состояние, где связаны 2К+, 6 атомов кислорода Х2 иона К+, требует конформационной перестройки белка и соответственно энергии АТФ.
K-Na-АТФаза работает в электрогенном режиме, так как обмен 3 ионов Nа на 2 йона К+ создает дополнительную разность потенциалов на мембране.
В мембранах существует также Са2+ зависимая АТФаза, имеющая ряд особенностей, сходных с NA, К-АТФазой. Ее рабочий цикл также включает связывание Са2+ и АТФ с образованием конформационно неустойчивого состояния, в котором изменяется сродство белка с ионом Са за счет энергии макроэргичеcкой фосфатной связи. Как и в случае Nа, К-АТФазы, изменение сродства здесь обусловлено, по-видимому, изменением расположения полярных групп, связывающих Са2+ в координационной сфере центра фермента.
Активный транспорт Н+ может проходить по Н+ каналам Н+-АТфазы, по которым они переносятся к активному центру, где осуществляется синтез – гидролиз АТФ.
Механизм самого переноса Н+ до конца неясен. Предполагается эстафетная передача протонов по системе водородных связей, которая сопровождается взаимным смещением донорно-акцепторных групп. Структура энергетических барьеров, определяющая скорость и направление переноса Н+ в Н+ канале, зависит от его конформационного состояния. Соответственно модификацию энергетического профиля иона в канале можно осуществить за счет энергии АТФ, кванта света (Н+ – канал в бактериородопсине), окислительно-восстановительных реакций.
.
Дата добавления: 2018-04-15; просмотров: 442; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
