ТЕМА 3. РАСТВОРЫ ГАЗОВ В ЖИДКОСТЯХ
3.1. Способы выражения растворимости газов
Газ, находящийся в контакте с жидкостью, растворяется в ней. Этот процесс называется абсорбцией. Обратный процесс выделения газа из жидкости называется десорбцией.
Раствор становится насыщенным, когда скорость абсорбции будет равна скорости десорбции. Растворимость газов в жидкостях измеряется концентрацией насыщенного раствора, которая может быть выражена любым способом: массовой концентрацией, молярной концентрацией, молярной долей и т.д.
Например, растворимость газов в воде часто выражают массовым коэффициентом растворимости (q): в граммах на 100 грамм воды при общем давлении газа (Ргаз) и паров воды (РН2О), равном 101325 Па:
Робщ = Ргаз + РН2О = 101325 Па
Иногда растворимость газов характеризуют коэффициентом абсорбции (a). Он показывает, какой объем газа, приведенный к нормальным условиям, растворяется в одном объеме жидкости при данной температуре (Т) и давлении газа, равном 1атм.
Например, если в 1 литре жидкости растворяется m0 грамм газа при давлении газа, равном Ргаз = 1атм, и температуре Т, то коэффициент абсорбции (aТ) равен:
 [
[  ] (4.1)
] (4.1)
где 22,4 литра – объем 1 моля газа при нормальных условиях; n =  – число молей газа, растворенных в 1 литре воды при температуре Т; М – молярная масса газа в г/моль.
– число молей газа, растворенных в 1 литре воды при температуре Т; М – молярная масса газа в г/моль.
Растворимость газов в жидкостях изменяется в широких пределах и зависит в первую очередь от природы газа и природы растворителя.
|
|
|
Например, растворимость природных газов в воде невелика. Растворимость их в нефти примерно в сотни раз больше, причем, увеличивается с возрастанием молярной массы и плотности газа и, наоборот, уменьшается с увеличением молярной массы и плотности нефти.
Растворимость газов зависит также от температуры, давления газа и концентрации растворенных в жидкости каких-либо веществ.
Зависимость растворимости газов от давления
При растворении газов в жидкостях их объем сокращается, поэтому в соответствии с принципом Ле-Шателье увеличение давления должно увеличивать и растворимость газов.
Количественно зависимость растворимости газов от давления выражается законом Генри: растворимость газа при постоянной температуре пропорциональна его давлению над жидкостью.
Уравнение закона Генри
с = kР (4.2)
где с – растворимость газа (концентрация насыщенного раствора); Р – давление газа над жидкостью; k – коэффициент пропорциональности (константа Генри), зависящий от природы газа и жидкости, от температуры, но не зависящий от давления.
|
|
|
Размерность константы Генри: k = с/Р [концентрация / давление]. Таким образом, численное значение константы зависит от способа выражения концентрации.
Закон Генри выполняется для идеальных растворов. В реальных растворах он соблюдается тем лучше, чем меньше растворимость газа и меньше его давление над жидкостью. Газы, взаимодействующие с жидкостью, закону Генри не подчиняются. Для смеси газов Дальтон установил, что растворимость отдельных компонентов газовой смеси прямо пропорциональна их парциальным давлениям и почти не зависит от присутствия других газов.
Закон Генри позволяет вычислять растворимость газов при различных давлениях. Например, если растворимость газа в воде при температуре Т и общем давлении газа и паров воды Р0 = 101325 равна qт(г / 100г Н2О) Па, то закон Генри можно записать следующим образом:
qт = kт´Ргаз = kТ´(Р0 – РН2О) (4.3)
где РН2О – давление паров воды при температуре Т, а давление газа равно
Ргаз = Р0 – РН2О.
Откуда константа Генри будет равна:
 (4.4)
(4.4)
При каком-то произвольном значении давления газа Р в 100г Н2О при температуре Т растворится следующее количество (mТ) грамм газа:
|
|
|
mт = kт´Ргаз =  (4.5)
(4.5)
Если растворимость газа выразить через его объем V, приведенный к нормальным условиям, растворяющийся в единице объема жидкости при температуре Т и давлении газа Ргаз, то закон Генри можно записать следующим образом:
V = kТ´Ргаз (4.6)
При давлении газа, равном Ргаз = Р0 = 101325 Па, объем V растворенного газа равен коэффициенту абсорбции, то есть V = aТ = kТ´Р0. Откуда
kТ =  (4.7)
(4.7)
Тогда уравнение (4.6) запишется следующим образом:
V = aТ  (4.8)
(4.8)
В этом случае константу Генри называют объемным коэффициентом растворимости. Он показывает, какой объем газа (приведенный к нормальным условиям) растворяется в единице объема жидкости при увеличении давления на единицу.
3.3. Зависимость растворимости газов от температуры
При увеличении температуры растворимость газов в соответствии с принципом Ле-Шателье уменьшается, так как все газы растворяются с выделением тепла (DНрас< 0).
Зависимость константы Генри от температуры выражается следующим уравнением:
|
|
|
ln kТ =  (4.9)
(4.9)
где DНрас – дифференциальная теплота растворения газа в насыщенном растворе; С – постоянная интегрирования. Это уравнение получается в результате интегрирования уравнения Клапейрона – Клаузиуса.
Для двух температур Т1 и Т2 уравнение (4.9) может быть записано следующим образом:
ln 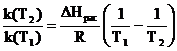 (4.10)
(4.10)
После подстановки в (4.10) уравнения (4.4) получается следующая зависимость:
ln  (4.11)
(4.11)
где Р1=101325-РН2О (Т!) и Р2=101325-– РН2О (Т2) - давления газа при Т1 и Т2.
Если в (4.10) подставить уравнение (4.7), то получается зависимость:
ln 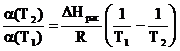 (4.12)
(4.12)
Решение типовых задач
Задача 1. Растворимость метана СН4 в воде при 30°С и общем давлении метана и паров воды Р0=101325 Па равна q=1.90´10-3 г / 100г Н2О. Давление паров воды при 30°С равно Рн2о=4242 Па. Вычислите коэффициент абсорбции метана при 30°С.
Решение. 1). Вычислим, какая масса метана растворится в 100 граммах воды при 30°С и давлении метана Ргаз=101325 Па. По уравнению (4.5)

В 1 литре воды растворится метана в 10 раз больше, то есть m0 = 1,98´10-2 грамм.
2). Вычислим, сколько молей метана растворится в 1 литре воды при 30°С и давлении метана Ргаз=101325 Па:
n =  СН4
СН4
М = 16,0 г/моль – молярная масса метана.
3). По уравнению (4.1) вычислим коэффициент абсорбции метана при 30°С, то есть объем, который займут при нормальных условиях n молей метана:
a = V0 = 22.4´n =22,4´1,24´10-3 = 2,78´10-2[  ]
]
Задача 2. Какой объем СО2, приведенный к нормальным условиям, растворится в 1м3 воды при 30°С, если давление СО2 равно Рсо2=2атм? Чему равна массовая концентрация с1(мас.%) газа в полученном растворе? Коэффициент абсорбции СО2 при 30°С равн a = 0,664.
Решение. Объём растворённого газа вычислим по уравнению (4.8):
V = aТ  = 0,664´
= 0,664´  =1,33 м3.
=1,33 м3.
Масса растворённого газа в 1м3 воды равна:
m (СО2) = 
М=44,0 ´10-3кг/моль – молярная масса СО2. Тогда массовая концентрация с1(мас.%) газа в полученном растворе будет равна:
с1(мас.%) = 
Задача 3.Под каким давлением надо растворять Н2S, чтобы получить при 30°С раствор с концентрацией 5%(мас.)? Растворимость Н2S при 30°С равна q = =0,298 г/100гН2О.
Решение. В 100 граммах 5% раствора содержится 5 грамм сероводорода и 95 г воды. Тогда на 100 г воды в этом растворе приходится: m=(5´100)/95=5,26 г Н2S. Чтобы получить 5% раствор давление Н2S должно быть равно (4.5):
Р Н2S = m ´  17,1´105Па.
17,1´105Па.
Задача. 4. В 1м3 воды растворили СО2 с образованием насыщенного раствора. Раствор нагревают от 30°С до 50°С. Какой объем при нормальных условиях займет выделившийся из воды газ? Общее давление газа и паров воды сохраняется постоянным и равным 101325 Па.
Растворимость диоксида углерода равна:
q(30°С)=0,125 г/100гН2О и q(50°С)=0,076 г/100гН2О
Решение.В 1м3 воды при 30°С растворяется m(30°С)= q(30°С) ´104=1,25´103г СО2, а при 50°С – m(50°С)= q(50°С) ´104=7.6´102г СО2. Таким образом, из 1м3 раствора выделится:
Dm = 1,25´103 - 7.6´102 = 4,9´102 г СО2
При нормальных условиях 4,9´102г СО2 займут объем:
V=22.4´n=22.4´Dm/МСО2=22,4´  2.5´102 литров = 0,25 м3
2.5´102 литров = 0,25 м3
Задача 5.Вычислите теплоту растворения сероводорода Н2S в интервале температур
30°-50°С. Растворимость сероводорода при 30°С равна q1= 0,298 г/100гН2О, а при 50°С равна q2= 0,188 г/100гН2О. Давление Н2S при 30°С равно Р1= 97083Па, а при 50°С - Р2= 88995Па.
Решение.Теплоту растворения можно вычислить по уравнению (4.11):
DНрас =  ln
ln 
DНрас = 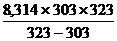 ´
´  = -1,52´104Дж/моль
= -1,52´104Дж/моль
Задача 6.Используя значение теплоты растворения DНрас, вычисленное в задаче 5, рассчитайте растворимость Н2S при Т3=313 К. Сравните полученный результат с табличным значением растворимости q(40°С)=0,236 г/100гН2О, Р3(Н2S)=93950Па.
Решение. Из уравнения (4.11):
ln q(40°С) = ln q(30°С) + ln 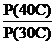 +
+ 
= ln 0,298 + ln 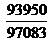 -
-  -1,436
-1,436
откуда q(40°С) = 0,238 г/100гН2О, что совпадает табличным значением с точностью до 1%.
Дата добавления: 2018-04-15; просмотров: 3718; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
