Тема 1. ГАЗООБРАЗНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
1.1. Идеальный газ
Идеальным называется газ, у которого собственный объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом, и между молекулами которого отсутствует взаимодействие.
Свойства идеального газа описываются уравнением состояния Клапейрона - Менделеева:
РV = nRT, (1.1)
где P – давление; V – объем; Т – температура (К); n - число молей газа;
R = 8,314 Дж/моль´К– универсальная газовая постоянная.
Если m– масса газа (кг), М – масса 1 моля газа (кг/моль), то
n= 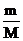 .
.  (1.2)
(1.2)
Плотность идеального газа (r) может быть вычислена по формуле:
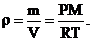 (1.3)
(1.3)
При нормальных условиях (Ро = 101325 Па, То = 273,15 К) один моль любого идеального газа занимает объем Vo = 22,41´10 –3 м3 (следствие из закона Авогадро). Этот объем называется нормальным молярным объемом. Тогда плотность идеального газа ro(кг/м3) при нормальных условиях можно определить по его молярной массе М(кг/моль):
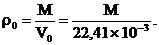 (1.4)
(1.4)
1.2. Смесь идеальных газов
Компонентный состав смеси газов может быть выражен в массовых сi(мас) и объемных сi(об) процентах, а также в молярных долях уi:
|
|
|
сi(мас)= 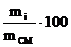 %, (1.5)
%, (1.5)
сi(об)= 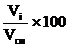 %, (1.6)
%, (1.6)
уi = 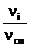 . (1.7)
. (1.7)
Здесь mi – масса i -го газа в смеси; mсм – масса смеси;
Vi – парциальный объем i-го газа; Vсм– объем газовой смеси;
ni – число молей i-го газа; nсм – сумма молей всех газов в смеси.
Так как объемы 1 моля идеальных газов при одинаковых условиях по закону Авогадро имеют одно и то же численное значение, то молярные доли газов равны объемной доле или сi(об), деленной на 100:
yi = 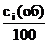 (1.8)
(1.8)
Газовая смесь характеризуется средней молярной массой:
Мсм= М1y1 + M2y2 +…+Mkyk = 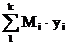 (1.9)
(1.9)
Связь между массовым и объемным процентным составом имеет следующий вид:
сi(мас) = сi(об) 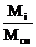 (1.10)
(1.10)
Плотность газовой смеси может быть вычислена по формуле (1.3):
rсм= 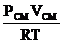 ,
,
а при нормальных условиях – по формуле (1.4):
ro(см) = 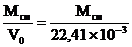
Для идеальной газовой смеси уравнение Клапейрона - Менделеева (1.1) запишется следующим образом:
|
|
|
РсмVсм = 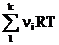 или РсмVсм =
или РсмVсм = 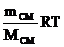 (1.11)
(1.11)
Для смеси идеальных газов выполняется закон Дальтона:
Рсм = Р1 + Р2 +¼+ РК, (1.12)
и закон Амага: Vсм = V1 + V2 +¼+ VК . (1.13)
Здесь Рi – парциальное давление i-го газа - это давление, которое производил бы газ при температуре и объеме газовой смеси;
Vi – парциальный объем i-го газа – это объем, который занимал бы газ при температуре и давлении газовой смеси.
Из (1.1) и (1.11), следует:
Рi = 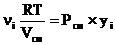 (1.14)
(1.14)
Vi = 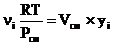 . (1.15)
. (1.15)
1.3.Ральные газы
В поведении реальных газов наблюдаются отклонения от законов идеальных газов. Они тем больше, чем выше давление и ниже температура.
Отклонения реальных газов от идеального состояния обусловлены двумя причинами: силами притяжения между молекулами и собственным объемом молекул. Взаимное притяжение приводит к уменьшению расстояния между молекулами и вызывает уменьшение объема, занимаемого газом, то есть действует как некоторое добавочное давление, приложенное извне к газу. Это давление получило название внутреннего.
|
|
|
Собственный объем уменьшает пространство между молекулами и влияет на длину их свободного пробега. При высоких давлениях и низких температурах расстояние между молекулами газа настолько уменьшается, а силы притяжения настолько увеличиваются, что газ может перейти в жидкое состояние.
Согласно теории для каждого газа существует такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Эта температура называется критической (Ткр).
Критическая температура – это максимальная температура, при которой паровая и жидкая фазы могут находится в равновесии. Выше ТКР существование жидкой фазы невозможно. При Т > Ткр нет различий между жидким и газообразным состояниями – существует единое аморфное состояние, называемое флюидным (или флюидом), а также мезоморфным.
При критической температуре для сжижения газа требуется наибольшее давление, которое также называется критическим (Ркр).
Объем одного моля газа при Ткр и Ркр называется критическим (Vкр); а состояние газа при Ткр и Ркр называется критическим состоянием.
|
|
|
Для расчета свойств реальных газов в уравнение (1.1) вводится поправочный коэффициент сжимаемости (z), учитывающий отклонение реальных газов от идеальных:
РV = znRT (1.16)
Для идеального газа z = 1, и уравнение (1.16) переходит в уравнение (1.1).
Величину z вычисляют по приведенным параметрам: приведенной температуре 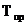 =
= 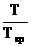 и приведенному давлению
и приведенному давлению 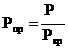 , где ТКР – критическая температура газа и РКР – критическое давление газа.
, где ТКР – критическая температура газа и РКР – критическое давление газа.
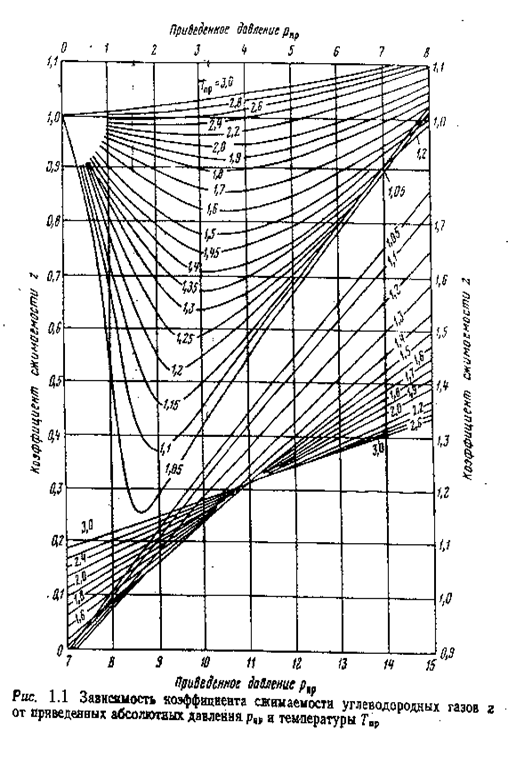
Для нахождения коэффициента сжимаемости используют графики (рис. 1.1) или таблицы (см. табл. 1.3).
В практике эксплуатации нефтяных скважин наиболее часто встречаются следующие интервалы давлений и температур углеводородной составляющей газа: Р = 0 – 20 МПа, Т = 273 – 355 К. Тогда коэффициент сжимаемости можно вычислить по уравнениям (1.17) – (1.20).
Когда Рпр изменяется от 0 до 3,8 и Тпр изменяется от 1,17 до 2,0,
z=1- РПР[0,18/( ТПР-0,73)-0,135]+0,016 РПР3,45/ ТПР6,1; (1.17)
когда Рпр изменяется от 0 до 1,45 и Тпр изменяется от 1,05 до 1,17,
z = 1 – 0,23РПР – (1,88 – 1,6ТПР)Р2ПР; (1,18)
когда Рпр изменяется от 1,45 до 4,0 и Тпр изменяется от 1,05 до 1,17,
z = 0,13РПР + (6,05ТПР – 6,26)ТПР / Р2ПР. (1.19)
Для азота при Р = 0 – 20МПа и Т = 280 – 380К:
z = 1 + 0,564´10-10(Т –273)3,71´ 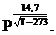 (1.20)
(1.20)
Коэффициент сжимаемости смеси реальных газов (zСМ) вычисляется по уравнению:
zСМ = z1y1 + z2y2 + ¼ + zКyК, (1.21)
где zi – коэффициенты сжимаемости отдельных газов, составляющих смесь; yi – их молярные доли.
Другой способ вычисления zСМ основан на том, что смесь рассматривается как единый газ.
Тогда газовой смеси можно приписать значения псевдокритической температуры:
ТПКР = Т1кр y1 + Т2кр y2 +¼ + ТКкр yК ; (1.22)
и псевдокритического давления:
РПКР = Р1кр y1 + Р2кр y2 + ¼+ РКкр yК . (1.23)
По этим значениям вычисляют приведенные псевдокритические параметры смеси газов:
ТПР = Т / ТПКР и РПР = Р / РПКР. (1.24)
По ТПР и РПР вычисляют кэффициент сжимаемости смеси по графикам, приведенным на рисунке 1.1, или по уравнениям (1.17) – (1.20) и таблице 1.3.
Уравнение (1.16) для смеси реальных газов имеет следующий вид:
РСМVСМ = zСМnСМ RT (1.25)
Плотность смеси реальных газов можно вычислить по формуле (1.3):
rсм = 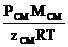 . (1.26)
. (1.26)
1.4. Решение типовых задач
Задача 1. Расчет свойств смеси идеальных газов.
Смесь газов имеет следующий компонентный состав: 70,0%(мас) СН4 и 30,0%(мас) С2Н6. Давление газовой смеси Рсм=1,013´105 Па, температура Т=310К.
Вычислить: а) объемный состав смеси;
б) парциальные давления газов;
в) среднюю молярную массу газовой смеси;
г) объем 1кг смеси.
Решение. 1). В 1кг смеси содержится 0,700 кг СН4 и 0,300кг С2Н6. Согласно уравнению (1.2) это соответствует следующему числу молей:
метана nСН4= 0,700:16,0´10-3 = 43,8 молей;
этана nС2Н6=0,300:30,0´10-3 = 10,0 молей.
Общее число молей равно: nСМ=43,8+10,0=53,8молей.
По уравнению (1.7) молярные доли газов равны:
y СН4= 43,8:53,8 = 0,814;
yС2Н6 = 1-yСН4 = 1-0,814 = 0,186.
Объемные концентрации идеальных газов (%) равны их молярным долям. умноженным на 100 (1.8). Таким образом, объемный состав смеси следующий: метан-81,4%; этан-18,6%.
2). Парциальные давления газов равны общему давлению газовой смеси, умноженному на молярную долю газа (1.14):
РСН4= Рсм´.yСН4 = 1,013´105´0,814 = 8,25´104Па;
РС2Н6 = 1,013´105 – 8,25´104 = 1,88´104Па.
3). Средняя молярная масса газовой смеси равна (1.9):
МСМ = МСН4´yСН4+МС2Н6´yС2Н6 = 16,0´10-3´0,814+30,0´10-3´0,186 =
=18,6´10-3кг/моль.
4).Объем 1кг смеси вычисляется по уравнению Клапейрона-Менделеева (1.11):
VСМ = nСМ 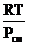 = (53,8´8,314´310):1,013´105 = 1,37 м3.
= (53,8´8,314´310):1,013´105 = 1,37 м3.
Здесь nСМ- число молей газов в 1 кг смеси.
Задача 2.Расчет свойств смеси реальных газов.
Вычислить плотность газовой смеси (см. задачу 1) при РСМ=15,0 МПа и Т=322К.
Решение. При данных условиях (РСМ больше РКР) плотность реальных газов (r) рассчитывается по уравнению (1.26):
rсм = 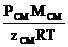 .
.
Для вычисления zсм выпишем из таблицы 1.2 критические параметры газов:
| Газ | Критическая температура ТКР,К | Критическое давление РКР, МПа |
| СН4 | 190,7 | 4,70 |
| С2Н6 | 306,2 | 4,90 |
Молярные доли газов равны (см. задачу 1): yСН4= 0,814; yС2Н6 = 0,186.
По уравнениям (1.22) и (1.23) вычислим псевдокритические параметры газовой смеси.
ТПКР= ТКР(СН4) ´ yСН4 + ТКР(С2Н6) ´ yС2Н6=190,7´0,814+306,2´0,186=212,2 К;
РПКР= РКР(СН4) ´yСН4 + РКР(С2Н6) ´ yС2Н6=4,70´0,814 +4,90´0,186=4,74 МПа
Приведенные критические параметры согласно (1.24) равны:
ТПР=ТСМ/ ТПКР=322:212,2=1,52; РПР=РСМ/ РПКР=15,0:4,74=3,17.
Коэффициент сжимаемости zсм находим по приведенным параметрам, используя график (см. рис.1.1): zсм = 0,78.
Плотность газовой смеси будет равна (1.26):
rСМ = (15,0´106´18,6´10-3):(0,78´8,314´322) = 1,4´102кг/м3.
Примечание. Коэффициент сжимаемости можно вычислить по уравнению(1.17) или определить по таблице 1.3.
1.5 МНОГОВАРИАНТНЫЕ КОНТРОЛЬНЫЕ ЗАДАЧИ
Расчет свойств смеси идеальных и реальных газов
Задача №1.В таблице 1 приведен массовый состав (%) смеси газов А, Б, В. При давлении Р1 = 101325 Па и температуре Т1 (см. табл. 1) смесь подчиняется законам идеальных газов.
Вычислите: а) объемный состав смеси;
б) парциальные давления компонентов;
в) объем 1 кг смеси.
Задача №2. Вычислите плотность смеси при температуре Т2 и внешнем давлении Р2 (см. табл. 1). Критические параметры газов приведены в таблице 2. Коэффициент сжимаемости найдите по графику (рис.1) и таблице 3.
Таблица 1.1. Массовый состав газовой смеси
|
Вариант |
А |
Б |
В | Массовая концентрация, % |
Т1,К |
Т2,К |
Р2, мпа | ||
| А | Б | В | |||||||
| 1 | СН4 | С2Н6 | С3Н8 | 40 | 33 | 27 | 340 | 380 | 10 |
| 2 | N2 | CH4 | C2H6 | 10 | 30 | 60 | 300 | 390 | 10 |
| 3 | N2 | CH4 | C3H8 | 8 | 23 | 69 | 350 | 390 | 10 |
| 4 | N2 | CO2 | CH4 | 3 | 76 | 21 | 340 | 350 | 11 |
| 5 | CH4 | C2H6 | C5H12 | 15 | 35 | 50 | 380 | 480 | 12 |
| 6 | N2 | CH4 | C2H6 | 5 | 50 | 45 | 340 | 360 | 9 |
| 7 | CO2 | CH4 | C3H8 | 4 | 36 | 60 | 300 | 380 | 10 |
| 8 | CO2 | CH4 | C2H6 | 12 | 60 | 28 | 300 | 380 | 11 |
| 9 | N2 | CH4 | C4H10 | 10 | 20 | 70 | 380 | 450 | 12 |
| 10 | C2H6 | C3H8 | C4H10 | 60 | 25 | 15 | 390 | 440 | 8 |
| 11 | CH4 | C2H6 | C3H8 | 30 | 30 | 40 | 350 | 390 | 10 |
| 12 | N2 | CH4 | C2H6 | 8 | 30 | 62 | 310 | 400 | 9 |
| 13 | N2 | CH4 | C3H8 | 6 | 25 | 69 | 340 | 390 | 11 |
| 14 | N2 | CO2 | CH4 | 4 | 72 | 24 | 350 | 390 | 10 |
| 15 | CH4 | C2H6 | C5H12 | 20 | 30 | 50 | 370 | 470 | 11 |
| 16 | N2 | CH4 | C2H6 | 6 | 48 | 46 | 330 | 390 | 10 |
| 17 | CO2 | CH4 | C3H8 | 10 | 30 | 60 | 310 | 380 | 9 |
| 18 | CO2 | CH4 | C2H6 | 14 | 50 | 36 | 320 | 390 | 11 |
| 19 | N2 | CH4 | C4H10 | 8 | 25 | 67 | 370 | 440 | 11 |
| 20 | C2H6 | C3H8 | C4H10 | 50 | 30 | 20 | 380 | 430 | 9 |
| 21 | CH4 | C2H6 | C3H8 | 30 | 35 | 35 | 330 | 370 | 11 |
| 22 | CO2 | CH4 | C2H6 | 15 | 50 | 35 | 310 | 390 | 10 |
| 23 | CH4 | C2H6 | C3H8 | 20 | 25 | 55 | 370 | 400 | 11 |
Таблица 1.2. Критические параметры газов
| Газ | Ткр,К | Ркр, МПа |
| N2 CO2 | 126,2 304,2 | 3,39 7,39 |
| CH4 C2H6 | 190,7 306,2 | 4,7 4,9 |
| C3H8 C4H10 C5H12 | 369,8 425,2 470,4 | 4,3 3,8 3,4 |
Таблица 1.3.
| Приведенная темпера тура | Коэффициенты сжимаемости смеси газов при приведенном давлении смеси | ||||||||||
| 0,01 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1 | 1,5 | 2 | 3 | 4 | |
| 1,05 1,1 1,15 1,2 1,25 1,3 1,35 1,4 1,45 1,5 1,6 1,8 2,0 2,5 3,0 | 0,992 0,993 0,993 0,993 0,994 0,995 0,995 0,995 0,996 0,996 0,996 0,996 0,996 0,997 0,998 | 0,988 0,988 0,988 0,989 0,989 0,989 0,992 0,992 0,992 0,993 0,993 0,993 0,994 0,994 0,995 | 0,96 0,961 0,961 0,965 0,966 0,967 0,968 0,970 0,972 0,974 0,976 0,978 0,988 1,01 1,02 | 0,89 0,87 0,92 0,93 0,935 0,940 0,945 0,950 0.952 0,953 0,955 0,958 0,96 1,01 1,02 | 0,86 0,78 0,82 0,84 0,86 0,87 0,89 0,91 0,93 0,95 0,96 0,97 0,98 1,015 1,02 | 0,82 0,72 0,76 0,82 0,83 0,85 0,87 0,89 0,91 0,92 0,94 0,965 0,970 1,02 1,03 | 0,55 0,68 0,72 0,76 0,81 0,83 0,84 0,86 0,89 0,905 0,92 0,96 0,97 0,98 1,04 | 0,28 0,38 0,52 0,63 0,70 0,74 0,78 0,82 0,84 0,86 0,88 0,93 0,95 0,99 1,08 | 0,29 0,36 0,44 0,55 0,63 0,68 0,73 0,76 0,79 0,83 0,86 0,92 0,94 0,99 1,07 | 0,42 0,44 0,49 0,53 0,58 0,63 0,68 0,71 0,74 0,76 0,82 0,89 0,94 0,96 1,07 | 0,54 0,57 0,58 0,61 0,64 0,66 0,69 0,72 0,76 0,78 0,82 0,89 0,94 1,0 1,09 |
 |
Тема 2. ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Испарение и кипение жидкостей
По сравнению с газами внутреннее строение жидкостей значительно сложнее. Поэтому описание свойств жидкости через уравнение состояния невозможно. Принято описывать каждое свойство жидкости отдельными уравнениями. К наиболее важным свойствам жидкости относятся: давление насыщенного пара, температура кипения, теплота испарения, вязкость, поверхностное натяжение.
2.1. Давление насыщенного пара
Различают два вида образования пара: испарение и кипение.
Испарение – это непрерывный процесс перехода вещества из жидкого состояния в газообразное.
Кипение– это парообразование при температуре, когда давление насыщенного пара равно внешнему давлению.
Насыщеннымназывается пар, который находится в равновесии с жидкостью (скорость испарения равна скорости конденсации). Давление насыщенного пара зависит от природы жидкости и температуры.
Зависимость давления насыщенного пара от температуры может быть представлена тремя способами: графиком, таблицей, уравнением. Например, для небольшого интервала температур давление насыщенного пара (Р) можно вычислять по уравнениям:
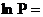
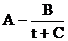 , (2. 1)
, (2. 1)
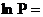
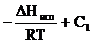 , (2. 2)
, (2. 2)
где А, В, С, С1—коэффициенты, индивидуальные для каждой жидкости;DН исп – теплота испарения; t – температура в °С; Т – температура в градусах Кельвина.
Когда коэффициент С равен 273.15, тогда уравнение (2.1) переходит в уравнение (2.2). По этим уравнениям можно выполнять различные расчеты: вычислять температуру кипения жидкости и температуру конденсации пара, величину внешнего давления, которое необходимо создать, для того, чтобы жидкость закипела при заданной температуре, рассчитать теплоту испарения и количество энергии, которое необходимо для перегонки известной массы жидкости.
Температура, при которой давление насыщенного пара равно внешнему давлению (Р = РАТМ), называется температурой кипения жидкости.
Из уравнения (2. 1) следует, что температуру кипения можно вычислить по формуле:
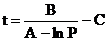
 , (2. 3)
, (2. 3)
здесь Р – внешнее давление, при котором кипит жидкость.
Температура кипения при внешнем давлении Р = 101325 Па называется нормальной температурой кипения (Тнтк). Из уравнения (2.3) видно, что уменьшение внешнего давления приводит к снижению температуры кипения, увеличение – к повышению.
Процесс перехода пара в жидкость называется конденсацией. Конденсация пара начинается при температуре, когда ненасыщенный пар становится насыщенным. Чтобы вычислить температуру конденсации (при постоянном давлении), надо в уравнение (2.3) подставить давление ненасыщенного пара.
Теплота, необходимая для изотермического испарения одного моля жидкости, называется теплотой испарения (DHисп). Приблизительно ее можно вычислить по правилу Трутона:
DHисп = 89,12 Тнтк Дж/моль (2.4)
Точнее теплоту испарения можно вычислить по уравнению (2.2), если известны давления насыщенного пара (Р1 и Р2) при двух температурах (Т1 и Т2):
DHисп 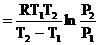 (2.5)
(2.5)
Зная теплоту испарения, можно вычислить расход энергии (Q) на перегонку известной массы (m) жидкости:
Q = DHисп 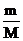 , (2.6)
, (2.6)
где М – молярная масса жидкости.
2.2. Решение типовых задач
Задача 1. Зависимость давления насыщенного пара декана С10Н22 от температуры в интервале от 75 до 210 °С имеет вид:
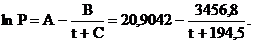
Вычислите нормальную температуру кипения Тнтк.
Решение. Нормальной называется температура кипения жидкости при атмосферном давлении, равном 101325 Па. По уравнению (2.3) получаем:
t 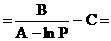
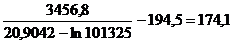 °С.
°С.
Задача 2. Каким должно быть внешнее давление, чтобы жидкость (С10Н22) закипела при 20°С?
Решение. По уравнению (2.1)
ln P = 20,9042-3456,8:(20+194,5) = 4,788,
откуда Р = 120 Па.
Задача 3. При какой температуре начнется конденсация пара С10Н22, если его давление равно 5,33´104 Па?
Решение. По уравнению (2.3):
t 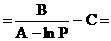 =
= 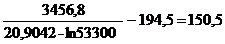 °С.
°С.
Задача 4. Вычислите теплоту испарения DHисп (по правилу Трутона) и расход энергии Q на перегонку одной тонны С10Н22,, допуская процесс идущим при нормальных условиях.
Решение. По правилу Трутона (2.4)
DHисп = 89,12 Тнтк =89,12´447,3=3,985´104Дж/моль.
Тогда по уравнению (2.6)
Q = DHисп´n = DHисп 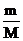 = 3,985´104´1000/0,142 = 2,81´108 Дж.
= 3,985´104´1000/0,142 = 2,81´108 Дж.
Здесь n - количество молей в 1 тонне декана, М - молярная масса декана.
Задача 5. Вычислите среднюю теплоту испарения С10Н22 вблизи нормальной температуры кипения от 437,3 до 447,3 К. Сравните её с теплотой испарения, вычисленной по правилу Трутона. Сделайте вывод о справедливости правила Трутона.
Решение. По уравнению (2.1) вычислим давление насыщенного пара декана при 164,1°С:
ln P = A 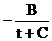 = 20,9042-3456,8:(t+194,5) = 11,264,
= 20,9042-3456,8:(t+194,5) = 11,264,
тогда Р = 7,800´104 Па.
Теплоту испарения вычисляем по уравнению (2.5):
DHисп = 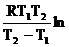
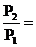
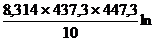
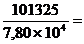 4,25´104Дж/моль.
4,25´104Дж/моль.
Расхождение с теплотой испарения, вычисленной по правилу Трутона, составляет примерно 6%.
2.3. МНОГОВАРИАНТНЫЕ КОНТРОЛЬНЫЕ ЗАДАЧИ
Испарение и кипение жидкостей
Используя зависимость давления насыщенного пара от температуры (см. таблицу 1), решите следующие задачи.
Задача 1. Вычислите нормальную температуру кипения жидкости (Тнтк).
Задача 2. Каким должно быть внешнее давление, чтобы жидкость закипела при 20°С?
Задача 3. Ненасыщенный пар охлаждается при постоянном давлении. При какой температуре начнется конденсация пара, если его давление равно 5,33´104 Па?
Задача 4. Вычислите теплоту испарения жидкости (по правилу Трутона) и расход энергии на перегонку одной тонны жидкости, допуская процесс идущим при нормальных условиях.
Задача 5. Вычислите среднюю теплоту испарения жидкости вблизи нормальной температуры кипения: от (Тнтк – 10) до Тнтк; сравните её с теплотой испарения, вычисленной по правилу Трутона. Сделайте вывод о справедливости правила Трутона.
Таблица 1. Зависимость давления насыщенного пара органических соединений от температуры
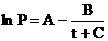
(P – давление в Па; t –температура в °С; А,В,С – константы)
| Вариант | Органическое соединение | А | В | С | Интервал температур, С° |
| 1. 2. | Пентан С5Н12 Гексан С6Н14 | 20,7201 21,7460 | 2477,2 3414,9 | 233,4 265,9 | -30 до 120 -60 до 110 |
| 3. 4. | Гептан С7Н16 Октан С8Н18 | 20,7812 20,8353 | 2917,1 3120,5 | 216,8 209,5 | -60 до 130 40 до 156 |
| 5. 6. | Циклопентан С5Н10 Циклогексан С6Н12 | 20,7345 20,6540 | 2577,1 2771,2 | 230,7 222,9 | -60 до 130 -20 до 142 |
| 7. 8. | Бензол С6Н6 Толуол С7Н8 | 20,8085 20,9034 | 2796,8 3094,5 | 221,2 219,4 | 5,5 до160 20до200 |
| 9. | Метиловый спирт (метанол) СН3ОН | 25,2511 | 4638,5 | 273,15 | +5 до 70 |
| 10. | Этиловый спирт (этанол) С2Н5ОН | 26,0065 | 5089,1 | 273,15 | +15 до 80 |
| 11. 12. | Изогексан С6Н14 (2 метилпентан) 2,2диметилбутанС6Н14 | 20,6404 20,4463 | 2614,4 2489,5 | 226,6 229,3 | -60 до 100 -80 до 95 |
| 13. 14. | 2 метилгексан С7Н16 Изооктан С8Н18 | 20,7190 20,4453 | 2846,1 2814,0 | 219,6 216,3 | -60 до125 +20 до150 |
| 15. 16. | 3-этилгексан С8Н18 Этилбензол С8Н10 | 20,7598 20,9123 | 3057,6 3279,5 | 212,6 213,2 | 25 до 150 45 до 190 |
| 17. 18. | О-ксилол С8Н10 Нонан С9Н20 | 21,0084 20,8615 | 3395,6 3289,96 | 213,7 201,6 | 50 до 200 60 до 185 |
| 19. 20. | Хлорбензол С6Н5Cl Четыреххлористый углерод ССl4 | 20,8843 20,8587 | 3253,8 2860,8 | 216,0 230,0 | 40 до 200 -15 до 138 |
Дата добавления: 2018-04-15; просмотров: 2049; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
