Дифференциальная сканирующая калориметрия.
Метод дифференциальной сканирующей калориметрии (DSC) основан на непрерывной регистрации разности теплового потока от образца и эталона или к образцу и эталону (изменения энтальпии) как функции температуры или времени при нагревании образцов в соответствии с определенной программой в заданной газовой атмосфере.
Метод предоставляет информацию о температурах и теплотах фазовых переходов (плавления, кристаллизации, стеклования), термодинамике и кинетике химических реакций, химическом составе, чистоте, термической и окислительной стабильности различных материалов и т.д.
Метод широко используется для исследований химических соединений, полимерных и композитных материалов в различных отраcлях науки и промышленности.
Эндо- и экзотермические реакции.
Все химические реакции сопровождаются выделением или поглощением тепла. Реакции первого типа называются экзотермическими, реакции второго типа — эндотермическими. Мерой теплоты реакции служит изменение энтальпии ΔН1, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная.
Теплота реакции ΔН и изменение свободной энергии ΔG2 не всегда имеют сравнимые значения. В действительности известны реакции, протекающие спонтанно (ΔG < 0) несмотря на то, что являются эндотермическими (ΔΗ > 0). Это происходит потому, что на прохождение реакции оказывает влияние изменение степени упорядоченности системы. Мерой изменения упорядоченности системы служит изменение энтропии ΔS.
|
|
|
1 – энтальпия системы (от греч. enthalpo нагреваю) - это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, связана с внутренней энергией U соотношением: H=U+PV, где V – объем системы
2 – это функция состояния системы, называемая изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж): ΔG=ΔH–TΔS
Энтропия1 системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца:
|
|
|
ΔG=ΔH-TΔS.
1 – энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы; возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS>0 (второй закон термодинамики)
Для эндотермических реакций в изобарно-изотермических условиях изменение стандартной свободной энергии Гиббса имеет положительное значение: ∆G0 > 0.
Таким образом, продукты реакции содержат больше энергии чем исходные компоненты.
Эндотермические реакции противоположны экзотермическим реакциям. К эндотермическим реакциям принадлежат реакции восстановления металлов из оксидов, фотосинтез в растениях и др.
Экзотермические реакции — химические реакции, сопровождающиеся выделением теплоты. При выделении теплоты энтальпия системы уменьшается.
График Аррениуса и определение энергии активации температурных реакций.
Уравнение Аррениуса, температурная зависимость константы скорости К элементарной химической реакции:
К=Аexp(-Еа / kТ)
где A – предэкспоненциальный множитель (размерность совпадает с размерностью К), Еа -энергия активации, обычно принимающая положительные значения, Т – абсолютная температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу, а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в уравнении Аррениуса величину k заменяют газовой постоянной R.
|
|
|
К=Аexp(-Еа / RТ)
График зависимости 1nК от 1/kT (график Аррениуса) – прямая линия, отрицательный наклон которой определяется энергией активации Еа и характеризует положительную температурную зависимость К.
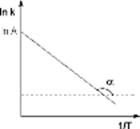
Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в химическую реакцию, т. е. для преодоления барьера потенциальной энергии на поверхности, отделяющего реагенты от продуктов реакции. Потенциальный барьер - максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. Высота потенциального барьера для любого пути, проходящего через переходное состояние, равна потенциальной энергии в переходном состоянии. Если в сложной реакции, состоящей из последовательных и параллельных элементарных реакций, имеется лимитирующая элементарная реакция (реакция с максимальным характерным временем), то ее энергия активации является и энергией активации сложной реакции. В макроскопической химической кинетике энергия активации – энергетический параметр Еа, входящий в уравнение Аррениуса К=Аexp(-Еа / RТ). Наблюдаемая энергия активации вычисляется из тангенса угла наклона прямой графика Аррениуса. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся). Любой процесс, сопровождающийся каким-либо изменением энергии, является экзотермическим в одном направлении и эндотермическим в другом. Энергии активации экзотермического и эндотермического направлений реакции, обозначаемые соответственно Е-а и Е+а , связаны соотношением: Е+а=Е-а+|Q|, где Q - .теплота реакции при Т=0. Качественная одномерная геометрическая иллюстрация связи энергии активации с высотой потенциального барьера и теплотой реакции представлена на рисунке, где q -координата реакции; Е1 и Е2 - уровни энергии соответственно основного состояния реагентов и продуктов реакции.
|
|
|

Энергетическая схема элементарной реакции.
Аналитическое применение методов ДТА и ДСК.
Позволяет проводить анализ изменения массы и тепловых потоков в одном эксперименте для одного и того же образца. Сочетая методы ТГА (термографический анализ) и ДСК, можно определить следующие характеристики материалов: с помощью ТГА фиксируется изменение массы образца при программируемом изменении температуры, при этом так же определяется массовый остаток вещества после термовоздействия.
С помощью ДСК определяются следующие характеристики: теплота плавления кристаллических веществ, удельная теплоемкость в широком диапазоне температур, температура стеклования полимерных материалов, степень кристалличности энтальпия реакции термостойкость и устойчивость к окислению старение материалов чистота веществ фазовые переходы, полиморфные превращения идентификация продукта по набору теплофизических характеристик.
Можно проводить анализ:
· изменения массы
· поведения разложения
· термической стабильности
· перехода энтальпий
· температуры фазовых переходов
· переходов стеклования
· поведения при кристаллизации
· фазовых диаграмм
· влияния добавок
Лекция 6.
Термогравиметрия.
Наряду с методом дифференциально-термического анализа веществ активно развивалась и вторая ветвь термического анализа – метод термогравиметрии. С помощью последнего можно с высокой степенью точности проследить за изменением массы пробы при повышении температуры.
Термогравиметрия – это метод исследования, заключающийся в измерении изменения массы образцов при нагревании. Первоначальную схему метода можно представить следующим образом: пробу нагревали до определенной температуры, затем охлаждали и после охлаждения взвешивали с аналитической точностью. Процесс повторяли циклически, каждый раз увеличивая температуру. Если результаты взвешивания, относящиеся к отдельным температурным значениям, представить в координатах температура – масса образца и соединить полученные точки, то получится кривая, именуемая термогравиметрической (ТГ). Описанный метод является исключительно длительным и неточным, но применяется и сегодня, например, при аналитическом определении потери массы при прокаливании вещества. Значительно быстрее и точнее проводить измерения с помощью термовесов, непрерывно регистрирующих изменение массы пробы.

Принцип работы термовесов следующий. Пробу помещают в тигель (рис. 3), опирающийся на коромысло весов. Затем тигель нагревают в электрической печи так, чтобы его температура равномерно повышалась. Температура печи измеряется с помощью находящейся в ней термопары, к концам которой подключен милливольтметр, и время от времени (например, каждые 5...10 К) масса образца фиксируется.
Графически изображенные результаты измерения дают термогравиметрическую кривую (рис. 4). Если изменение массы регистрируется автоматически, кривая ТГ строится в зависимости не от температуры, а от времени, однако такая замена оси абсцисс обратима, если одновременно фиксируется и зависимость температуры в печи от времени. Наиболее просто замена оси абсцисс осуществляется в том случае, когда повышение температуры в печи происходит равномерно во времени.

На основании кривой ТГ можно судить о том, каким образом изменялась при нагревании масса пробы, например, при каких температурах и на сколько миллиграммов менялась масса пробы осадка ацетата кальция, а следовательно, при каких температурах происходили химические превращения Ca(СОО)2*H2O → Ca(СОО)2 → CaСО3 → CaО.
Степень изменения массы определяется в зависимости от типа термовесов с точностью, примерно, от 0.5 до 0.1%, поэтому на основании результатов измерения можно производить довольно точные стехиометрические1 расчеты.
1 – стехиометрия – наука о соотношении массовых или объемных долей реагирующих веществ
Конструкция термовесов постоянно модифицировалась. Первый экземпляр термовесов сконструировал японский исследователь Гонда в 1915 г. Впоследствии многие исследователи шли по пути совершенствования именно его конструкции. Среди используемых в настоящее время есть весы, качающиеся по призмам, весы с подвешенным коромыслом, весы с тормозящей нитью, весы пружинного типа, весы, снабженные жидкостным, воздушным или электромагнитным затуханием. Но, рассуждая объективно, ни одному из многочисленных типов нельзя отдать безусловное предпочтение.
Как изучение процессов, происходящих при нагревании глинистых минералов и пород, потребовало широкого распространения и развития метода ДТА, так и нерешенные вопросы определения постоянного состава аналитических осадков ускорили распространение метода термогравиметрии. Для исследования же иных вопросов последний метод долгое время применялся очень редко.
Недостатки термогравиметрии обнаруживаются только тогда, когда целью испытания является определение хода процесса разложения. Кроме того, в тех случаях, когда две реакции следуют плотно друг за другом либо перекрывают друг друга или же чередуются реакции с большими и небольшими изменениями массы, тогда метод термогравиметрии оказывается неопределенным и оценка кривой становится затруднительной и неточной.
Указанные трудности попытались устранить конструированием вакуумных термовесов. Сущность термогравиметрических испытаний в вакууме заключается в том, что выделившиеся газообразные побочные продукты немедленно удаляются из внутренней части материала, вследствие чего равновесие реакций разложения смещается в сторону разложения. Между твердой и газообразной фазами всегда устанавливается равновесие, изменяющееся в соответствии с парциальным давлением газовых продуктов. Термическое разложение в вакууме обычно происходит в узких температурных пределах и быстро, поэтому плотно следующие друг за другом реакции лучше отделяются друг от друга.
Эти же проблемы вынудили исследователей разработать новый статический метод термогравиметрии, который был назван ими методом ступенчатого изотермического нагревания. Такой метод испытания несмотря на применение в нем автоматически работающих современных термовесов в действительности означал возвращение к старому методу периодического нагревания и взвешивания. Температуру печи при испытании не увеличивали до тех пор, пока масса пробы не становилась постоянной. Затем, незначительно увеличив температуру, опять дожидались постоянства массы. Таким способом удалось достичь того, что даже в случае медленно происходящих процессов устанавливалось равновесие, соответствующее данной температуре, и реакции, происходящие при более низкой температуре, не смешивались с реакциями, протекающими при более высокой. Полученные кривые показывают резкие и определенные переломы, значительно облегчающие оценку. Однако применение этого метода целесообразно лишь в исключительных случаях, так как процесс измерения является весьма длительным.
Таким образом, несмотря на всевозможные ухищрения, предпринимаемые для устранения трудностей оценки кривой ТГ, исследователям стало ясно, что необходим качественно новый подход к измерению.
Дата добавления: 2018-04-15; просмотров: 913; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
