Возбуждающий постсинаптический потенциал (ВПСП)
Процессы, протекающие на мембранах в области синаптических контактов, отличаются от распространяющегося импульса (потенциала действия). В химических синапсах процесс передачи информации является локальным, возникает в постсинаптической мембране после выброса в синаптическую щель химического посредника – медиатора. Признаки возбуждающего постсинаптического потенциала такие же, как и признаки местного возбуждения:
· отсутствует рефрактерность
· значительная длительность
· способность суммироваться (с другими подобными синаптическими процессами)
· отсутствие способности к активному распространению
Рассмотрим процессы возникновения постсинаптической деполяризации на примере холинергического нервно-мышечного окончания.
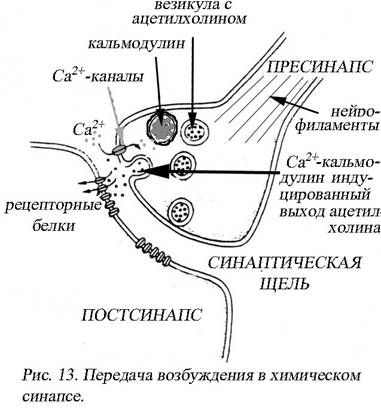
Пресинаптическая область содержит разные по размеру и строению везикулы (замкнутые в собственные мембраны полости). Одни содержат медиатор – ацетилхолин, другие модулятор действия медиатора – кальмодулин, третьи – нейросекрет; способны к перемещениям. Предполагается, что вещество, предшественник медиатора попадает в нервную клетку или в нервное окончание из крови или из церебральной/цереброспинальной жидкости, подвергается биохимическим превращениям при участии ферментов, транспортируется в область пресинапса. В частности, ацетилхолин синтезируются в цитоплазме синаптического окончания, и там же молекулы медиатора депонируются в синаптических пузырьках. Ферменты, необходимые для синтеза медиатора, образуются в теле нейрона и доставляются в синаптическое окончание путем медленного аксонного транспорта. Синтез медиатора и образование синаптических пузырьков осуществляются непрерывно (рис. 13).
|
|
|
Перемещения везикул в пресинапсе осуществляются при участии нейрофиламентов. Особая роль в сближении синаптических везикул с мембраной принадлежит синапсинам – молекулам фосфопротеинов, обильно покрывающих поверхность синаптических пузырьков.
Пусковым механизмом высвобождения медиатора в синаптическую щель является потенциал действия на пресинаптическом нервном окончании. Для активации экзоцитоза медиатора необходимы ионы Са2+, находящиеся во внеклеточном матриксе в достаточно большом количестве. Экспериментально доказано, что в случае отсутствия Ca2+ в окружающей синапс среде передача возбуждения становится невозможной. В состоянии покоя кальциевые каналы пресинаптической мембраны закрыты, уровень Са2+ в синаптическом окончании низок и выделения медиатора практически не происходит. Приход в синаптическое окончание волны деполяризации приводит к открытию потенциалчувствительных кальциевых каналов. Ионы Са2+ поступают в цитоплазму синаптического окончания и взаимодействуют с кальмодулином. Сам кальмодулин не проявляет ферментативной активности, но является интегральной субъединицей целого ряда ферментов: протеинкиназы, протеинфосфатазы, фосфодиэстеразы (в клетках организма способен связывать и активировать более 40 мишеней). Под действием комплекса Ca2+-кальмодулин начинается миграция синаптического пузырька.
|
|
|
Существует два механизма экзоцитоза медиатора. В первом случае всё содержимое везикулы оказывается в синаптической щели: медиатор, АТФ, ионы, ассоциированные белки и ферменты и пр. Но есть и другой принципиальный механизм высвобождения медиатора – экзоцитоз без полного слияния, с частичным освобождением (kiss and run – от англ. «поцеловал и убежал»). Он характеризуется формированием временной поры (канала) в пресинаптической мембране, сообщающей полость везикулы с синаптической щелью. В этом случае через нее по градиенту концентрации медиатор будет диффундировать в синаптическую щель только тогда, пока пора будет находиться в открытом состоянии, а везикула при каждом контакте с пресинаптической мембраной теряет только часть своего содержимого и может многократно участвовать в экзоцитозе. Пора обладает селективностью, и другие ингредиенты везикулы при этом виде экзоцитоза в синаптическую щель не выделяются.
|
|
|
Секреция нейромедиатора осуществляется в специализированных активных зонах – участках утолщения пресинаптической мембраны. Количество активных зон в нервно-мышечном синапсе достигает 30 – 40, в межнейронных синапсах – около десятка. Активные зоны расположены против скоплений рецепторов в постсинаптической мембране, что уменьшает задержку в передаче сигнала, связанную с диффузией нейромедиатора в синаптической щели.
Синаптическая щельимеется между пре- и постсинаптическими мембранами. Величина щели неодинакова в различных синапсах. Так, в нервно-мышечном окончании, где медиатором является ацетилхолин, ширина синаптической щели достигает 30 нм. Пространство синаптической щели заполнено межклеточной жидкостью, а в нервно-мышечном окончании коллоидом (поэтому часто синаптическую щель в нервно-мышечном окончании рассматривают как базальную мембрану).
Постсинаптическая мембранасодержит на своей поверхности рецепторы – белки, обладающие большим сродством к медиатору. Определенному типу медиатора соответствует определенный тип рецептора, например, в нервно-мышечном окончании – холинорецепторы. Это липопротены, которые обладают высоким сродством к ацетилхолину. Они распознают медиатор в окружающей среде и вступают с ним во взаимодействие, образуя комплекс медиатор-рецептор. В результате этого взаимодействия происходят конформационные изменения белков-каналов на постсинаптической мембране, повышается ионная проводимость для катионов Na+ через соответствующий ионный канал.
|
|
|
Натриевый ток деполяризует участок постсинапса, но такая деполяризация, как мы уже говорили, не является самоподкрепляющимся процессом. Потенциалы, возникающие при работе химического синапса, зависят от количества выделенного медиатора, следовательно, градуальны. Они получили название миниатюрных потенциалов(минимальные значения ВПСП). Отдельные миниатюрные потенциалы способны суммироваться в пространстве и во времени. Деполяризация всей постсинаптической мембраны наступает только при достаточном количестве выделенного медиатора. Так, в нервно-мышечном окончании при экзоцитозе одного кванта медиатора из пресинапса рецептор постсинаптического компонента взаимодействует приблизительно с 1700 молекулами ацетилхолина. Однако это слишком ничтожная доза чтобы вызвать деполяризацию всего постсинапса, последняя развивается только при выделении около 3,5 тысяч квантов медиатора ацетилхолина.
При передаче нервного импульса с пресинапса на постсинапс всегда существует синаптическая задержка, равная 1-2мс. Это и есть то время, которое потрачено на вызванный ПД вход Са2+ в пресинапс, его взаимодействие с кальмодулином, перемещение везикул с медиатором к активной области пресинапса, выход медиатора в синаптическую щель, взаимодействие медиатора с рецептором, открытие Na+-каналов и деполяризацию постсинапса.
Восстановление работоспособности синапса происходит следующим образом. После возникновения миниатюрного потенциала, комплекс рецептор-медиатор перестает функционировать. Под действием фермента ацетилхолинэстеразы холинорецептор освобождается от ацетилхолина, что вызывает реполяризацию постсинаптической мембраны вследствие повышения проницаемости для К+. Ацетилхолин в свою очередь расщепляется до холина и уксусной кислоты. С помощью активного транспорта холин попадает в пресинапс, где используется для синтеза медиатора, уксусная кислота включается в метаболизм мышечного волокна. Проницаемость и чувствительность постсинапса возвращается к норме и его рецепторы снова готовы взаимодействовать с очередной порцией медиатора.
Лабильность химического синапса, как уже указывалось, довольно низка по сравнению с нервным волокном (125имп/c). В зависимости от вида синапса общая продолжительность ВПСП находится в диапазоне от 5 до 100 мс. От начала ВПСП до деполяризации всего постсинапса проходит еще около 0,3 мс.
В свете изложенного материала становятся понятными свойства химического синапа: одностороннее проведение возбуждения, синаптическая задержка, низкая возбудимость и лабильность. Скажем еще о некоторых свойствах:
· утомляемость – возникает в результате истощения запасов медиатора и АТФ.
· потенция – облегчение проведения нервного импульса после предварительной стимуляции. Механизм состоит в том, что в синаптической щели остается в свободном виде некоторое количество медиатора, которое присоединяется к новой выделяемой порции. Как следствие для повторного возбуждения требуется меньшая порция медиатора.
· десенситизация – уменьшение чувствительности рецептора к большим концентрациям медиатора. При непрерывном связывании медиатора с рецептором, конформация каналообразующего белка меняется так, что ионный канал становится непроницаемым для ионов: передача возбуждения становится невозможной. Это эффективный механизм завершения синаптических процессов.
Поведем итог вышесказанному:
1. ВПСП – это электрический процесс, возникающий в мембране постсинапса, обеспечивающий передачу возбуждающих влияний одной клетки на другую. Минимальное значение ВПСП представляет собой миниатюрный потенциал, развивающийся при выделении одного кванта медиатора. Демонстрирует свойства локального ответа.
2. ПД в постсинапсе возникает только при достаточной величине ВПСП.
3. Спад ВПСП происходит благодаря физико-химическим свойствам мембраны. Открытие Na+-каналов не носит самоподкрепляющийся регенеративный характер, зависит только от количества медиатора. Десенситизация препятствует возникновению стойкой деполяризации постсинаптической мембраны.
4. ВПСП отражает действие на клетку не одного, а целого ряда синаптических окончаний. Если большое число синапсов возбуждается одновременно или почти одновременно, то возникает явление суммации, которое проявляется в виде возникновения ВПСП существенно большей амплитуды, что может деполяризовать мембрану всей постсинаптической клетки.
Следует уточнить, что описанные выше процессы передачи возбуждения классифицируются как ионотропные. Такое название возникло в связи с особенностями работы рецептора постсинапса. Ионоторпные (каналообразующие) рецепторы имеют ионный канал и место связывания медиатора на одной белковой молекуле. В этом случае результатом образования комплекса медиатор-рецептор является открытие ионного канала и изменение проницаемости постсинаптической мембраны для ионов, как мы только что рассмотрели на примере ацетилхолина. Такой механизм синаптических процессов называется первым типом синаптической передачи информации.
Метаботропные (каталитические) рецепторы, в которых через белок-рецептор активируется цепочка внутриклеточных ферментативных реакций. При этом происходит изменение метаболических процессов через системы внутриклеточных посредников (мессенджеров). Такой механизм обеспечивает второй тип синаптической передачи. Он широко распространен в синапсах, где медиаторами являются биогенные амины (дофамин, серотонин, адреналин и др.). По метаботропному типу функционируют не только рецепторные белки постсинапса, но и белки-рецепторы пресинаптической мембраны. Они также могут взаимодействовать с медиатором, осуществляя регулирование процессов экзоцитоза по принципу обратной связи.
Торможение в нервной системе
Торможение, как и возбуждение, является активным процессом, возникающим в ответ на действие стимула, характеризуется изменением физико-химических свойств клетки, но сопровождается угнетением функциональных отправлений. Еще одна отличительная черта торможения – отсутствие способности к активному распространению по нервной клетке и ее отросткам.
В зависимости от того тормозится ли деятельность нервных центров, или же рабочих органов торможение классифицируется как центральное или периферическое. Центральное торможение открыто И.М. Сеченовым в 1863 году. Эксперимент, проведенный на среднем мозге лягушки (помещение кристаллов NaCl между передними и задними холмиками крыши вызывало торможение двигательной активности животного), позволил предположить, что здесь находятся тормозные клетки. Открытие оказало глубокое влияние на изучение не только нейродинамики, но и регуляции психических процессов. Однако Сеченов правильно оценил наблюдаемый феномен, но ошибся в его механизмах. Эта ошибка была исправление И.П. Павловым. Клетки мозга лягушки, раздражаемые хлоридом натрия, являются возбуждающими вставочными нейронами ретикулярной формации ствола мозга. Они предают возбуждение тормозным клеткам спинного мозга (Реншоу), а те, возбуждаясь, тормозят мотонейроны. Поскольку клетки Реншоу принадлежат ЦНС, название типа торможения осталось прежним, сеченовским – центральное.
Периферическое торможение было обнаружено в 1840 г. братьями Эрнстом и Эдуардом Веберами, получившими задержку сердечных сокращений при ритмическом раздражении блуждающего нерва. Природа торможения длительное время оставалась неясной. Первоначально физиологи отождествляли его с пассивным состоянием или истощением соответствующих клеток. Работы И.М. Сеченова и В. Пашутина положившие начало исследованию реципрокных взаимоотношений процессов возбуждения и торможения показали, что торможение не сводится только к утомлению нервных центров. В настоящее время выявлено два различных способа торможения клеточной активности: торможение может либо быть результатом активации особых тормозных структур – первичное, либо возникать как следствие предварительного возбуждения клетки – вторичное.
Первичное торможение осуществляется за счет выделения тормозного медиатора пресинаптическим компонентом. К таким медиаторам относятся γ-аминомасляная кислота, глицин, таурин, серотонин и др. Эти вещества вызывают гиперполяризацию постсинаптической мембраны.
Ацетилхолин – вошел в историю физиологии как медиатор двойного действия – возбуждающий в нервно-мышечном окончании и тормозной в сердечной мышце вегетативных ганглиях стенки желудка. Рецепторы нервно-мышечных окончаний являются никотиновыми холинорецепторами, возбуждаются не только ацетилхолином, но и никотином. Сложнее с мускариновыми холинорецепторами (возбуждаются ацетилхолином и мускарином, ядом некоторых грибов). Наиболее часто они встречаются в вегетативном парасимпатическом отделе нервной системы, их стимуляция оказывает возбуждающий эффект. Однако в сосудах и сердце стимуляция м-холинорецепторов приводит к развитию тормозящего эффекта в отношении кардиомиоцитов и гладких мышечных элементов.
Причины возникновения этого тормозного постсинаптического процесса стали понятны с развитием молекулярной биологии. Как оказалось, мускариновые рецепторы относятся к рецепторам метаботоропного типа, их функция включает процессы метаболизма. Связывание трансмиттера с рецептором активирует мембранные G-белки. Одна молекула медиатора при связывании с рецептором может активировать много молекул G-белка, и это усиливает эффект медиатора. В неактивном состоянии G-белок обычно связан с молекулой ГДФ – гуанозиндифосфата. При взаимодействии с комплексом медиатор-рецептор ГДФ фосфорилируется до ГТФ – гуанозинтрифосфата (источник энергии для активации субстратов в метаболических реакциях) и конфигурация G-белка меняется. Именно в состоянии комплекса с ГТФ G-белок способен быть активатором следующего компонента системы – фермента, образующего вторичный мессенджер. У вторичных мессенджеров есть много возможностей для осуществления влияния на ионные каналы. С их помощью определенные ионные каналы могут открываться или закрываться. Если открываются ионные каналы для входа Na+, то развиваются процессы деполяризации и возникает ВПСП. Именно так развиваются процессы взаимодействия ацетилхолина с мускариновыми метаботропными рецепторами в центральных отделах мозга и вегетативных ганглиях.
Однако комплекс G-белок-ГТФ способен открывать калиевые каналы, что приводит к выходу К+ во внеклеточную среду и развитию процессов гиперполяризации мембраны, которая и вызывает тормозной постсинаптический потенциал (ТПСП). Эти процессы развиваются при воздействии ацетилхолина на рецепторы атипичных кардиомиоцитов проводящей системы сердца, гладкие миоциты стенки сосудов.
Правильный вывод относительно механизмов действия ацетилхолина таков: ацетилхолин оказывает возбуждающее или тормозное действие при взаимодействии с метаботропным рецептором в зависимости от особенностей каскада химических реакций, в результате которых различные ионные каналы открываются при помощи вторичных мессенджеров. Откроются каналы для К+ и Cl- – разовьется гиперполяризация (ТПСП), для Na+ – деполяризация (ВПСП).
Вторичное торможение возникает без участия специализированных тормозных клеточных структур, связано с предшествующим процессом возбуждения. Причины возникновения данного типа торможения очень разнообразны:
· запредельное торможение возникает в результате поступления к клетке импульсов очень высокой частоты. Вследствие этого развивается чрезмерная синаптическая деполяризация, приводящая к инактивации ионных каналов.
· парабиотическое торможение развивается при длительно действующих нагрузках или действии очень сильных раздражителей. Причина – развитие явлений парабиоза в тканях.
· пессимальное торможение при действии раздражителей, превышающих лабильность нейрона. Механизм состоит в накоплении следовых гиперполяризационных процессов, снижающих активность нейрона.
· торможение вслед за возбуждением
· торможение по принципу отрицательной индукции
· условное (внутреннее) торможение
Для организации интегративной деятельности нервной системы вторичное торможение менее значимо по сравнению с первичным, отражает функциональное состояние организма. Первичное торможение имеет генетически закрепленную синаптическую и медиаторную специфику.
Дата добавления: 2018-04-05; просмотров: 95; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
