Характерные химические реакции
1. Диссоциация в водном растворе на ионы:
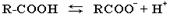
2. Образование солей:
а) при взаимодействии с металлами: 2RCOOH + Mg 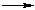 (RCOO)2Mg + H2↑
(RCOO)2Mg + H2↑
б) в реакциях с оксидами металлов: 2RCOOH + MgO 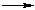 RCOOMg + H2O
RCOOMg + H2O
в) в реакциях с гидроксидами металлов: 2RCOOH + NaOH 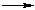 RCOONa + H2O
RCOONa + H2O
в) взаимодействие с солями слабых летучих кислот:
2RCOOH + Na2СO3 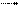 RCOONa + H2O + СО2↑
RCOONa + H2O + СО2↑
3. Образование сложных эфиров:
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации 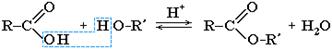
Ход работы.
Задание № 1.
Опыт 1. Диссоциация уксусной кислоты.
В пробирку налейте несколько капель раствора уксусной кислоты, поместите в пробирку с раствором уксусной кислоты полоску универсальной индикаторной бумаги. Пронаблюдайте изменение окраски индикатора.
В другую пробирку налейте несколько капель раствора соляной кислоты, поместите в пробирку с раствором соляной кислоты полоску универсальной индикаторной бумаги. Пронаблюдайте изменение окраски индикатора.
Сравните изменения окраски индикатора в двух случаях и сделайте вывод о силе кислот.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В пробирку положите одну гранулу цинка и добавьте 2 мл раствора уксусной кислоты. (Что наблюдаете?)
Подогрейте содержимое пробирки на пламени спиртовки. (Что изменилось? Почему?)
Опыт 3. Взаимодействие уксусной кислоты с оксидами металлов.
|
|
|
В пробирку поместите немного порошка оксида меди(II) и добавьте 1-2 мл раствора уксусной кислоты.
Опыт 4. Взаимодействие уксусной кислоты с основаниями
В пробирку налейте 1 мл раствора гидроксида натрия, добавьте несколько капель индикатора фенолфталеина. (Что наблюдаете?) Добавьте 2 мл раствора уксусной кислоты.
Опыт 5. Взаимодействие уксусной кислоты с солями
В пробирку налейте 1 мл карбоната натрия и добавьте несколько капель раствора уксусной кислоты. (Что наблюдаете?)
Отчет оформите в виде таблицы.
| Номер опыта | Уравнения реакций | Что наблюдали | Вывод |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 |
Задание № 2.
Теоретически рассмотрите химические свойства муравьиной кислоты.
Диссоциация муравьиной кислоты.
Взаимодействие муравьиной кислоты с металлами.
Взаимодействие муравьиной кислоты с оксидами металлов.
Взаимодействие муравьиной кислоты с основаниями
Взаимодействие муравьиной кислоты с солями
Взаимодействие муравьиной кислоты с аммиачным раствором оксида серебра
Отчет оформите в виде таблицы.
| №п/п | Уравнения реакций | Что должны наблюдать | Вывод |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 |
Сделайте вывод, ответив на вопросы.
|
|
|
Чему вы научились в ходе лабораторной работы?____________________
Наличием, какой функциональной группы обусловлены химические свойства карбоновых кислот?______________________________________________
Какой функциональной группой обусловлены особенные свойства муравьиной кислоты? ______________________________________________________
· Приведите в порядок используемые принадлежности и свое рабочее место.
|
|


|

Цель работы : закрепить и отработать на практике знания, полученные в результате изучения темы « Углеводы»
Оборудование: Штатив для пробирок, 6 пробирок, спиртовка, спички,пробирки,
Реактивы: Крахмал, глюкоза, р-р йода спиртовой, аммиачный р-р оксида серебра, сульфат меди (II) (р-р), гидроксид натрия, глицерин, этанол,дистиллированная вода.
Иструктаж по ТБ
Учащийся должен знать: классификацию углеводов, состав,химические свойства, качественные реакции, технику безопасности.
|
|
|
Учащийся должен уметь: пользоваться химическими реактивами, химической посудой, различать углеводы с помощью качественных реакций
Теоретическая часть.
1. С6Н12О6- глюкоза, моносахарид, содержится в ягодах, фруктах, винограде; альдегидоспирт, имеет две функциональные группы и проявляет свойства альдегидов и многоатомных спиртов.
- С=О альдегидная группа
\ Н
-(ОН) спиртовая группа
Качественная реакция на альдегидную группу: - СОН + Ag2O→2Ag + -COOH («серебряное зеркало»)
Качественная реакция на многоатомный спирт: взаимодействие со свежеприготовленным раствором гидроксида меди(II), при этом синий цвет реактива меняется на темносиний.
2. (С6Н10О5)n- крахмал, природный полимер, находится в картофеле, злаковых, бананах. Структурным звеном является глюкоза.
Качественной реакцией на крахмал является взаимодействие со спиртовым раствором йода, при этом образуется темносинее окрашивание.
3.Глицерин СН2-СН-СН2 – трехатомный спирт, сиропообразная,сладкая
L l l
ОН ОН ОН
|
|
|
жидкость.
Качественная реакция на многоатомный спирт: взаимодействие со свежеприготовленным раствором гидроксида меди(II), при этом синий цвет реактива меняется на темносиний.
Ход работы
1. Запишите в тетрадь тему практического занятия и номер варианта.
2. Приготовьте таблицу для оформления результатов работы.
3. Получите задание.
4. Составьте план решения задач
5. Проделайте опыты для решения задач
6. Составьте отчет о работе, используя таблицу
Отчет оформите в виде таблицы.
| № Варианта и № п/п | Наблюдения | Уравнения реакций | Результат ( выводы) |
Задание 1
1.Определите растворы веществ: крахмал, глюкоза.
2. Докажите, что выданное вещество – глицерин.
Задание 2
1.Определите вещества : глицерин и этанол.
2.Докажите, что данное вещество- крахмал
Ответьте на вопросы:
1.Почему глюкоза является альдегидоспиртом?
2.Качественная реакция на альдегиды, многоатомные спирты?
3.Структурным звеном крахмала является…
4.Качественная реакция на крахмал_________
Дата добавления: 2018-04-05; просмотров: 547; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
