Фильтрование под обычным давлением
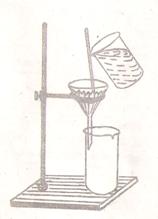 Для фильтрования под обычным давлением собирают прибор (рис. 3). Фильтровать жидкость следует как показано на рис. 3. Когда жидкости останется немного, осадок взбалтывают и переносят на фильтр. Жидкость, прошедшая через фильтр, называется фильтратом или маточным раствором. Остатки осадка смывают на фильтр дистиллированной водой из промывалки.
Для фильтрования под обычным давлением собирают прибор (рис. 3). Фильтровать жидкость следует как показано на рис. 3. Когда жидкости останется немного, осадок взбалтывают и переносят на фильтр. Жидкость, прошедшая через фильтр, называется фильтратом или маточным раствором. Остатки осадка смывают на фильтр дистиллированной водой из промывалки.
Промывание осадков производится водой или специальным растворителем, наливая его небольшими порциями, дают раствору полностью стечь и только после этого наливают следующую порцию. После 4-5 промывок проверяют качественно полноту отмывки от тех или иных примесей. Для этого в чистую пробирку отбирают несколько капель вытекающей жидкости и проводят реакцию на отмываемый ион (например, ион Cl- - AgNO3; ион SO42- - BaCl2. Появление мути требует дальнейшего промывания осадка. Промывную жидкость собирают отдельно от основного фильтрата.
Рис.3
Для отделения и промывания труднорастворимых и медленно фильтрующихся осадков применяется метод декантации. До начала фильтрования образовавшемуся осадку дают осесть на дно сосуда. Осветленный раствор осторожно сливают с осадка на фильтр. К осадку вновь приливают растворитель, перемешивают, дают раствору отстояться. Жидкость снова сливают, а к осадку приливают растворитель и так повторяют несколько раз. Затем осадок переносят на фильтр для дальнейшей промывки.
|
|
|
Задание. Собрать прибор для фильтрования под обычным давлением (рис. 3). Ознакомиться со штативом и его сборкой. Отфильтровать по заданию преподавателя 50 мл взвеси – песок – вода, глина – вода. Освоить методику количественного перенесения осадка, пользуясь палочкой и промывалкой.
Фильтрование под вакуумом
Для более быстрого отделения твердых веществ от жидкости применяют фильтрование под вакуумом. Фильтрование под уменьшенным давлением производится в приборе (рис. 4), который состоит из толстостенной колбы Бунзена (1) с боковым отростком и вставленной в нее, с помощью резиновой пробки, фарфоровой воронки Бюхнера (2) с решетчатым дном. На дно воронки помещают два фильтра один по диаметру дна воронки, а другой на 0,5 см больше первого. Обрезав по контуру воронки, фильтр окончательно подгоняют к воронке. Меньший фильтр кладется на дно воронки, смачивается водой и прижимается к дну воронки, а сверху кладется второй фильтр, края которого расправляются по стенкам воронки. Разряжение создается с помощью насоса. Прибор присоединяют к насосу для того, чтобы фильтры плотно присосались к дну и стенкам воронки, 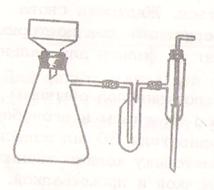 затем прибор отключают. В воронку Бюхнера при помощи стеклянной палочки, наливают раствор с осадком, после чего прибор присоединяют к насосу через
затем прибор отключают. В воронку Бюхнера при помощи стеклянной палочки, наливают раствор с осадком, после чего прибор присоединяют к насосу через
|
|
|
Рис. 4
предохранительную склянку. Разряжение в колбе следует создавать постепенно по мере накопления осадка. Осадок на фильтре следует отжать.
После окончания фильтрования колбу следует отсоединить от предохранительной склянки (почему?) и только после этого закрыть водопроводный кран.
Для извлечения осадка из воронки ее вынимают из колбы, переворачивают на лист фильтровальной бумаги и, ударяя рукой по воронке, удаляют осадок. Вместо воронки Бюхнера для этих же целей можно пользоваться тиглями Гуча или стеклянными воронками Шотта с различным диаметром пор.
Задание. По указанию преподавателя собрать прибор с воронкой Бюхнера и стеклянной воронкой Шотта. Ознакомиться с работой водоструйного или др. насоса.
ЛАБОРАТОРНАЯ РАБОТА №5
Важнейшие классы неорганических соединений
Оборудование, реактивы: колбы, пробирки, аппарат Киппа, шерстяные нити. Растворы серной, соляной и азотной кислот, оксиды кальция, железа (III), меди (II), алюминия, фосфора (V), кремния (IV), свинца (II), гидроксиды натрия и калия, медный купорос, хлорид меди (II), сульфат алюминия, сульфат хрома, наборы реактивов для решения экспериментальных задач.
|
|
|
Задания. 1. Проделайте опыты. 2. По заданию преподавателя решите одну экспериментальную задачу. 3. Выполните по школьному учебнику практическую работу «Получение медного купороса взаимодействием оксида меди (II) c серной кислотой».
Опыт 1. Гидратация основных оксидов. Взаимодействие основных оксидов с водой удобнее всего демонстрировать на реакции гидратации оксида кальция.
В стеклянный стакан с несколькими кусочками негашеной извести наливают воду. Оксид кальция сначала заметно впитывает воду, затем начинается бурная реакция, признаками которой являются сильное разогревание, выделение обильного количества водяных паров и характерное шипение.
В результате реакции из кусков негашеной извести получается мелкий порошок гашеной извести (пушонка). К взвеси полученного порошка в воде приливают раствор красного лакмуса или бесцветного фенолфталеина. Изменение цвета индикатора доказывает наличие щелочи.
|
|
|
Опыт 2. Доказательство того, что не все основные оксиды гидратируются. Берут соответствующий оксид (меди, железа, алюминия и т.д.) и высыпают в воду. Внешних признаков реакции не наблюдается, взвесь этих веществ в воде не изменяет окраску индикаторов, так как взятый оксид не вступает реакцию с водой. Большинство основных оксидов не гидратируюся.
Опыт 3. Взаимодействие основного оксида с кислотой. К небольшому количеству (на кончике перочинного ножа) оксида меди (II) прибавляют разбавленной соляной или серной кислоты (1:5), пробирку нагревают. Изменение окраски раствора показывает, что образовалась растворимая соль меди. Целесообразно взять избыток кислоты, чтобы оксид меди (II) полностью прореагировал (иначе не вступивший в реакцию оксид меди(II) в виде суспензии черного цвета будет маскировать окраску полученного раствора).
Свойство оксидов взаимодействовать с кислотами с образованием соли и воды является характерным для основных оксидов, на основе этого свойства дается их определение в школе.
Опыт 4. Гидратация кислотных оксидов.Лучше всего эту реакцию демонстрировать на примере взаимодействия оксида фосфора (V) с водой. В пробирку кладут 1г оксида фосфора (V) и приливают 1мл воды. При этом наблюдают разогревание, характерное шипение, выделение паров испаряющейся воды. Происходит реакция соединения оксида фосфора (V)с водой.
Испытание полученного раствора раствором синего лакмуса показывает наличие кислоты.
Опыт 5. Доказательство того, что не все кислотные оксиды гидратируются. К хорошо промытому оксиду кремния (IV) (речной песок) приливают дистиллированной воды, взбалтывают получившуюся взвесь и испытывают раствором синего лакмуса. Цвет не изменяется. Следовательно, как и в случае с основными оксидами, реакцию гидратации нельзя считать характерной для всех кислотных оксидов.
Опыт 6. Взаимодействие кислотных оксидов с основаниями. а) Воздух, обогащенный оксидом углерода (IV), продувают через известковую воду.
б) Взаимодействие твердой щелочи с кислотным оксидом можно показать, используя для этого прибор. Колбу заполняют оксидом углерода (IV), закрывают пробкой с газоотводной трубкой, конец ее опускают в сосуд с водой. Никакого засасывания воды не наблюдают. Затем газоотводную трубку плотно закрывают зажимом, открывают пробку и в колбу высыпают 2-3г хорошо измельченного гидроксида натрия или калия. Закрывают колбу пробкой и несколько раз энергично ее встряхивают. Колба разогревается, внутренние стенки ее отпотевают. Оксид углерода (IV) прореагировал со щелочью. Для доказательства этого конец газоотводной трубки опускают в сосуд с водой, открывают зажим, вода энергично входит в колбу.
Ценность опыта заключается не только в том, что в нем можно наблюдать взаимодействие оксида углерода (IV) со щелочью, но и в том, что можно наблюдать образование воды и выделение теплоты.
в) Плоскодонную колбу заполняют оксидом углерода (IV). В колбу насыпают 7-8г хорошо истертой твердой щелочи (КОН или NaOH). Колбу закрывают пробкой с газоотводной трубкой, соединенной с аппаратом Киппа, в котором получают оксид углерода (IV). Если открыть кран аппарата Киппа, то вследствие того, что оксиду углерода (IV) нет выхода, раствор поднимается в верхний шар. Но стоит несколько раз встряхнуть колбу, начинается реакция между щелочью и оксидом углерода (IV). Аппарат Киппа начинает работать, так как в колбе все время расходуется оксид углерода (IV)который реагирует со щелочью. Реакция идет энергично, ко дну колбы прилипают щелочь и продукты ее реакции, выделяются капельки воды. Колба сильно разогревается, и если на дно положить кусочек парафина, то он плавится и растекается.
Выделение теплоты удобно демонстрировать при помощи приложенной ко дну колбы бумаги, смоченной водой. Заметно выделение паров воды.
После остывания колбы в нее вливают немного разбавленной соляной или серной кислоты, наблюдается вспенивание, так как получившийся к колбе карбонат при взаимодействии с кислотой дает оксид углерода (IV).
Опыт 7. Растворимость оснований в воде, действие растворов едких щелочей на ткани. а) В пробирку кладут несколько кусочков щелочи (KOH или NaOH), добавляя немного воды, после встряхивания пробирки отмечают выделение теплоты, щелочь растворяется в воде.
б) В пробирку с раствором щелочи (из предыдущего опыта) опускают в виде линейной петли шерстяную нить. После нагревания пробирки из нее вынимают шерстяную нить, беря ее за концы, и слегка растягивают на воздухе, нить расползается.
в) В пробирку насыпают немного (на кончике перочинного ножа) гашеной извести. Пробирку наполовину заполняют водой и хорошо взбалтывают. После отстаивания извести не видно заметного ее растворения. Но если добавить несколько капель раствора фенолфталеина, то окраска его указывает на то, что раствор содержит гидроксогруппы, т.е. известь немного ратсворилась.
Опыт 8. Получение нерастворимых оснований. Четверть стакана заполняют раствором гидроксидом натрия, к которому приливают раствор медного купороса до выпадения густого киселеобразного осадка гидроксида меди. Полученный гидроксид меди следует отфильтровать на воронке Бюхнера, используя водоструйный насос или вакуумный насос из кабинета физики. Осадок несколько раз промывают водой, добиваясь того, чтобы фильтрат не давал щелочной реакции. Индикатор – фенолфталеин.
Опыт 9. Свойства нерастворимых оснований. (для опытов используют гидроксид меди из предыдущего опыта.) а) В стакан насыпают немного порошка гидроксида меди (II), приливают воды и добавляют 3-4 капли раствора фенолфталеина. Окраска фенолфталеина не изменяется.
б) Пробирку, на дне которой находится гидроксид меди, закрепляют в лапке штатива слегка наклонно в сторону ее отверстия и сильно нагревают. Выделяется вода, гидроксид меди превращается в оксид меди (II).
Этот же опыт можно проделать на слюдяной пластине. На пластину кладут гидроксид меди, берут ее тигельными щипцами или металлической держалкой для пробирок и сильно прокалывают на пламени спиртовки или газовой горелки. Гидроксид меди чернеет, превращаясь в оксид меди (II).
в) В стакан с гидроксидом меди приливают раствор соляной или серной кислоты. Происходит реакция нейтрализации между гидроксидом меди и кислотой.
Опыт 10. Получение амфотерных соединений и их свойства. а) В стакан наливают 10-15 мл 0,1 н.раствора едкого натра, к которому добавляют раствор той же концентрации сульфата или хлорида цинка до образования осадка. Полученный осадок необходимо разделить на две равные порции в два стакана. В один стакан прилить 1н. раствор кислоты (HCI H2SO4), а в другой – 1 н. раствор гидроксида натрия до растворения осадков. Объясните наблюдаемое являние.
б) Как и в предыдущей работе, проделайте опыты с другими солями – сульфатом алюминия и сульфатом хрома.
Основные классы неорганических соединений.
Вопросы:
1. Какие из указанных гидроксидов могут основные соли:
LiOH ,KOH, Cи(OH)2, Ca(OH)2, Al(OH)3, Fе(OH)3?
Ответ подтвердите уравнениями соответствующих реакций.
2. Ангидридом какой кислоты можно считать Cl2O7 : а)хлорной, б)хлорноватой, в) хлористой ,г) хлорноватистой
д) хлороводородной ?
3. какие из приведенных соединений относятся к пероксидам:
NO2, KO2, BaO2, MnO2, Mn2О7?
4. какая формула соответствует марганцовистой кислоте: а) HMnO, б) H4MnO4, в)H2MnО4?
5. какая соль образуется при взаимодействий 1 моль гидроксида цинка и 2 моль ортофосфорной кислоты: а) ортофосфат цинка, б) дигидроортофосфат цинка, в) ортофосфат гидроксоцинка, г) гидроортофосфат цинка? Запишите уравнения соответствующей реакций.
ЗАДАНИЯ
1. составить уравнения реакций, соответствующих следующим схемами преврвщений:
1.N2- NH3- NO- NO2 –HNO3- Cu(NO3)2-NO2
2.C-CO-CO2-Ca(HCO3)2 –CaCO3-Ca(HCO3)2
2.С какими из перечисленных ниже веществ будет реагировать соляная кислота:
NO2, Zn(OH)2, CaO, AqNO3, H3РО4, Pв(NO3)2, H2SO4, NACl?
3.Какие из перечисленных ниже веществ будут реагировать с гидроксидом натрия:
CaO, CO2, BeO, P2О5, HNO5, CuSO4, Fe(OH )4, Fl(OH)3?
Составить соответствующие уравнения реакций,
ЛАБОРАТОРНАЯ РАБОТА № -6
Смещение химического равновесия.
Влияниеттемпературы на скорость химической реакции
Основные вопросы. Понятие о химической кинетике. Элементарные (одностадийные) и неэлементарные (сложные) реакции. Скорость гомогенных химических реакций. Скорость гетерогенных химических реакций. Закон действия масс. Константа скорости реакции. Молекулярность и порядок реакции. Зависимость скорости реакции от температуры; энергии активации. Понятие о цепных реакциях. Понятие о гомогенном и гетерогенном катализе. Примеры каталитических процессов в промышленности. Химическое равновесие. Истинное и кажущее равновесие, их признаки. Константа химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье – Брауна. Влияние температуры, давления, инертного газа и концентрации реагентов на химическое равновесие.
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
В три пробирки отмерить по 3 мл 0,5 % - ного раствора серной кислоты. В следующие три пробирки налить: в I - 3 мл 0,5 % – ного раствора тиосульфата натрия, во II - 2 мл раствора тиосульфата натрия и 1 мл воды, в III - 1 мл раствора тиосульфата натрия и 2 мл воды. В каждую пробирку влить по 3 мл раствора серной кислоты, быстро перемешать и отметить время появления мути. Относительную скорость реакции определить как величину, обратно пропорциональную найденному времени в секундах. Полученные данные оформить в виде таблицы:
| Номер пробирки | Объем, мл | Относительная концентрация | Время появления мути t, с | Относительная скорость реакции n | |
| Na2S2O3 а | H2O в | ||||
Результаты опыта представить графически в координатах относительная концентрация – скорость.
Опыт 2. Зависимость скорости реакции от температуры.
В три пробирки отмерить по 1 мл тиосульфата натрия, в три другие пробирки – по 1 мл раствора серной кислоты. Пробирку с тиосульфатом и пробирку с кислотой термостировать в стакане с водой в течении 5 – 7 мин при комнатной температуре, затем слить содержимое пробирок и заметить время появления мути. Следующую пару пробирок термостировать при температуре на 10 0С выше, чем первую, слить содержимое и отметить время появления мути. Аналогичный опыт проделать с третьей парой пробирок , повысив температуру еще на 10 0С. Полученные данные оформить в виде таблицы:
| Номер пробирки | Температура, К | Время появления мути t, с | Относительная скорость реакции n |
Результаты опыта представить графически в координатах температура – относительная скорость.
Опыт 3. Влияние катализатора на скорость химической реакции.
В сухую пробирку внести шпателем небольшое количество порошка алюминия и мелко растертого иода. Содержимое пробирки перемешать стеклянной палочкой, добавить каплю воды. Как влияет вода на скорость реакции? На основании опытов 1 – 3 сделать вывод о влиянии концентрации, температуры и катализатора на скорость химических реакций.
Опыт 4. Смещение химического равновесия при изменении концентраций реагирующих веществ.
В пробирку влить приблизительно 1 мл 0, 0025 М раствора хлорида железа (III) и добавить такой же объем 0,0025 М раствора роданида калия. Как меняется окраска раствора? Полученный раствор разлить поровну в четыре пробирки. Одну пробирку оставить в качестве контрольной. Во вторую пробирку добавить несколько капель насыщенного раствора хлорида железа (III), в третью – несколько капель насыщенного раствора роданида калия, в четвертую – несколько кристалликов хлорида калия. Сравнить окраску растворов в пробирках. Составить уравнение происходящей обратимой реакции. Написать математическое выражение константы химического равновесия данного процесса. Какие вещества находятся в растворе при состоянии химического равновесия? Какое вещество придает раствору красную окраску? Как изменяется интенсивность окраски раствора при добавлении хлорида железа(III), роданида калия, хлорида калия? В каком направлении смещается равновесие исследуемой системы при этом? Концентрацию каких веществ и как нужно изменить, чтобы сместить химическое равновесие вправо? Влево?
Контрольные вопросы и задачи.
1. Что такое скорость химической реакции и от каких факторов она зависит? От каких факторов зависит константа скорости?
2. Составить уравнение скорости реакции образования воды из водорода и кислорода и показать, как измениться скорость, если концентрацию водорода увеличить в три раза.
3. Как изменяется скорость реакции с течением времени? Какие реакции называются обратимыми? Чем характеризуется состояние химического равновесия? Что называется константой равновесия, от каких факторов она зависит?
4. Какими внешними воздействиями можно нарушить химическое равновесие? В каком направлении смешается равновесие при изменении температуры? Давления?
5. Каким образом можно сместить обратимую реакцию в определенном направлении и довести до конца?
6. Реакция между веществами А и В выражается уравнением
А + 2В ® С
Начальная концентрация вещества А равна 0,3 моль/л, а вещества В – 0,5 моль/л. Константа скорости реакции равна 0,4 л/(моль. С). Расчитайте начальную скорость реакции и скорость реакции по истечению некоторого времени, когда концентрация А уменьшится на 0,1 моль/л. Ответ: n1 = 0,03 моль/(л. с), n2 = 0,0072 моль/(л. с).
12. Вычислите температурный коэффициент реакции g, если константа скорости этой реакции при 120 0С равна 5,88 . 10 – 4, а при 170 0С – 6,7 . 10 – 2. Ответ: 2,58.
13. Рассчитайте энергию активации реакции, если при увеличении температуры от 500 до 1000 К константа скорости химической реакции возросла в 105 раз. Ответ: 95,5 кДж/моль.
14. Определить энергию активации реакции, если при увеличении температуры от 330 до 400 К константа скорости реакции увеличилась в 105 раз. Ответ: 191 кДж/моль.
15. Написать уравнения констант равновесия для следующих реакций:
N2 + 3 H2 <=> 2 NH3
2 H2 + O2 <=> 2 H2O
H2 + Cl2 <=> 2 HCl
16. Как сместиться равновесие при повышении давления и снижения температуры в системе: 2 H2 + O2 <=> 2 H2O, DH0 = - 484 кДж?
17. Как повлияет изменение температуры и давления на состояние равновесия в системах:
N2 + O2 <=> 2 NO, DH0 = 180,7 кДж
N2 + 3 H2 <=> 2 NH3, DH0 = - 92,4 кДж?
18. Реакция между иодом и водородом протекает по уравнению H2 + I2 <=> 2HI
Равновесие установилось при следующих концентрациях веществ, участвующих в реакции: [H2] = [I2] = 0,005 моль/л; [HI] = 0,4 моль/л. Определить исходную концентрацию иода и константу равновесия. Ответ: 0,205 моль/л; Кр = 640.
19. Равновесие реакции 2СО + О2 <=> 2 СО2
установилось при следующих концентрациях реагирующих веществ: [CO] = 0,004 моль/л; [O2] = 0,04 моль/л; [CO2] = 0,004 моль/л. Определить константу равновесия и исходные концентрации оксида углерода (II) и кислорода. Ответ: Кр = 25; 0,008 моль/л; 0,042 моль/л.
ЛАБОРАТОРНАЯ РАБОТА № 7
Приготовление растворов
Дата добавления: 2018-04-05; просмотров: 684; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
