Для измерения объемов жидкостей используют разнообразную мерную посуду: мерные колбы, мерные цилиндры, мензурки, пипетки и др
Мерные колбы (рис. 21)служат для приготовления растворов точной концентрации и представляют собой круглые плоскодонные колбы с длинным и узким горлом, на котором нанесена тонкая черта. Эта отметка показывает границу, до которой следует наливать жидкость, чтобы ее объем соответствовал указанному на колбе значению. Цифры на колбе показывают объем жидкости (мл), на который она рассчитана. Мерные колбы обычно имеют притертые пробки. Применяют колбы на 50,100, 250, 500 и 1000 мл.
Мерные колбы меньшего объема, использующиеся для определения плотности жидкостей, называютсяпикнометрами.
Мерные цилиндры (рис. 22) представляют собой стеклянные сосуды, которые для большей устойчивости имеют широкое основание (дно) или специальную подставку. Снаружи на стенках цилиндров нанесены деления, указывающие объем (в мл). Мерные цилиндры бывают различной емкости: от 5 мл до 2 л. Их назначение – измерять (с определенной погрешностью) различные объемы жидкости.
Мензурки (рис. 23)-это сосуды конической формы с делениями на стенке.
Пипетки (рис. 24)служат для отбора точно определенных относительно небольших объемов жидкостей. Они представляют собой стеклянные трубки небольшого диаметра с делениями. Некоторые пипетки имеют расширение посредине (пипетки Мора). Нижний конец пипетки слегка оттянут и имеет внутренний диаметр до 1 мм. На верхнем конце пипетки имеется метка, до которой набирают жидкость. Некоторые пипетки снабжены двумя метками. Обычно пипетки имеют емкость от 1 до 100 мл.
|
|
|
Бюретки (рис. 25)служат для отмеривания точных объемов жидкостей, преимущественно при химико-аналитических работах (титрование). Они могут иметь различную конструкцию и иметь разный объем.
Пластмассовая посуда.
В лабораторной практике используют посуду, изготовленную из полимерных материалов (полиэтилен, полипропилен, фторопласт и др.) При высокой химической устойчивости такая посуда обладает низкой термостойкостью, и поэтому ее обычно используют в работах, не требующих нагревания. Из полиэтилена изготовляютворонки для жидких и сыпучих веществ,промывалки, капельницы, флаконы и банкидля транспортировки и хранения химических реактивов,пробиркидля центрифугирования, пипет-дозаторы и наконечники к ним и др.
Металлическое оборудование.
В химических лабораториях широко применяют разнообразное металлическое оборудование, преимущественно стальное.
Штативы (рис. 26)с набороммуфт, лапок и колециспользуют для закрепления на них во время работы различных приборов, стеклянной посуды (холодильников, колб, делительных воронок и пр.). Кольца, закрепленные на штативе, используют также при нагревании химической посуды на металлическихасбестированных сетках(рис. 27) газовыми горелками.
|
|
|
Треноги(рис. 28) применяют в качестве подставок для различных приборов, колб и пр. Они особенно удобны при нагревании крупных по размеру колб и громоздких приборов.
Держатели для пробирок (рис. 29) –приспособления, которые используются при непродолжительном нагревании пробирок.
Пинцеты(рис. 30) – приспособления для захватывания мелких предметов, а также веществ, которые нельзя брать руками, например, металлический натрий.
Тигельные щипцы (рис. 30)применяют для захватывания горячих тиглей при извлечении их из муфельной печи, снятия раскаленных тиглей с фарфоровых треугольников и при всех работах, когда приходится иметь дело с раскаленными предметами.
Зажимы (рис. 31)– приспособления, используемые для зажимания резиновых трубок. Обычно применяют пружинные зажимы (зажимы Мора)и винтовые (зажимыГофмана). Последние позволяют легко регулировать скорость вытекания жидкости или интенсивность прохождения газов.
Лабораторные нагревательные приборы.
В лаборатории применяют различные нагревательные приборы: газовые горелки, электрические плитки, бани, сушильные шкафы, муфельные печи и т. п.
|
|
|
Газовые горелки.Наиболее часто применяют газовые горелкиБунзенаиТеклю (рис.32). В газовых горелках предусмотрено регулирование поступления воздуха с помощью вращения диска (горелка Теклю) или поворотом хомутика (горелка Бунзена). Горелка Теклю с регулировочным диском – более совершенный прибор, так как в ней можно точнее регулировать не только доступ воздуха, но и приток газа (с помощью винта). Зажигать газовую горелку нужно только через 1-2 с после пуска газа и при небольшом доступе воздуха. Затем следует отрегулировать доступ воздуха так, чтобы пламя стало несветящимся.
ВНИМАНИЕ! Необходимо помнить, что природный газ ядовит и образует с воздухом взрывоопасные смеси. Поэтому нельзя допускать утечки газа!
Бани (рис.33). Для продолжительного нагревания в пределах температуры 100-3000С применяют бани: водяную, песчаную и др. Они представляют собой, как правило, металлические чаши, заполненные водой (водяная баня) или сухим, чистым песком, прокаленным для удаления из него органических примесей (песчаная баня). Нагревание бань проводят пламенем газовой горелки. Используются также водяные и песчаные бани с электрообогревом.
|
|
|
Электрические плитки.В тех случаях, когда требуется нагревание, а пользоваться горелками нельзя (например, при перегонке воспламеняющихся легколетучих жидкостей) применяют электрические плитки.
Для нагревания круглодонной стеклянной посуды применяютколбонагреватели (рис.34).
Печи.Для получения температуры 600-14000С применяются электрическиемуфельныепечи (рис.35). С помощью особого регулировочного устройства печь может нагреваться до определенной, заранее заданной температуры.
Сушильные шкафы (рис.36)имеют электрический обогрев и терморегулятор, позволяющий поддерживать постоянную температуру. Для наблюдения за температурой шкаф снабжен термометром. Высушиваемое вещество помещается в сушильный шкаф, отрегулированный на требуемую температуру, и выдерживается в нем при заданной температуре определенное время. В работах количественного характера сушку проводят несколько раз до достижения высушиваемым веществом постоянной массы.
 |
ЛАБОРАТОРНАЯ РАБОТА № 2.
Весы и взвешивание. Правила взвешивания.
Среднеквадратичная ошибка взвешивания
Взвешиванием на рычажных весах называют сравнение массы данного тела с массой гирь, масса которых известна и выражена в определенных единицах (мг, г, кг и др.). Весы являются важнейшим прибором в химической лаборатории, так как почти ни одна работа в ней не обходится без определения массы того или иного вещества или тары, в которую помешают взвешиваемое вещество.
Для взвешивания веществ с точностью до 0,01 г применяют техно-химические весы (рис. 1)
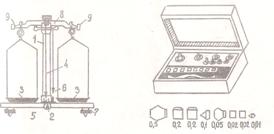
Рис. 1. Техно-химические весы и разновес (1 – колонка, 2-арретир, 3 – чашки весов, 4 – стрелка, 5 – шкала, 6 – отвес, 7 – винты для установки весов в горизонтальном положении, 8 – коромысло, 9 – винты для уравновешивания пустых чашек весов)
Принцип устройства техно-химических и аналитических весов один и тот же. На металлическом коромысле (равноплечий рычаг) имеются три призмы: два на концах и одна посередине его (рис. 2).
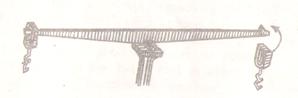
Рис. 2
Средняя призма покоится на пластинке, находящейся на центральной колонке весов и являющейся точкой опоры. В аналитических весах пластинка сделана из агата. На боковых призмах лежат пластинки, к которым подвешиваются чашки весов. Коромысло снабжено длинной стрелкой, которая показывают на шкале величину отклонения коромысла от горизонтального положения. При горизонтальном положении коромысла стрелка находится на нулевом делении шкалы.
Перед взвешиванием необходимо установить весы по отвесу. Переносить или сдвигать весы с места после установки не разрешается. Прежде чем приступить к взвешиванию, необходимо проверить весы. Для этого плавным поворотом винта, приподнимающего и опускающего коромысло (арретир), весы приводят в рабочее положение и наблюдают за качанием стрелки в ту и другую сторону от среднего деления шкалы, находящейся в нижней части весов. Если при этом стрелка отклоняется от средней линии шкалы на равное число делений в обе стороны, или же в одну сторону на 1-2 деления больше, чем в другую, то весы можно считать пригодными к работе. По окончании проверки весы необходимо арретировать, т.е. перевести в нерабочее положение обратным поворотом арретира.
При взвешивании необходимо соблюдать следующие правила:
1. Ставить предметы и разновесы на чашки весов, снимать их оттуда, касаться чем бы то ни было рабочей части весов можно только после того, как весы полностью арретированы.
2. Не ставить на чашку весов горячих, мокрых или грязных предметов. При работе с жидкостями ни в коем случае не допускать попадания жидкости на весы и разновесы.
3. Взвешиваемый предмет помещать на левую чашку весов, а разновесы на правую.
4. Не класть взвешиваемое вещество непосредственно на чашку весов. Твердые вещества взвешивать на часовых (вогнутых) стеклах, в бюксах, в тиглях или на листочках глянцевой бумаги.
5. Разновесы брать только пинцетом и при снятии с весов класть их в те гнезда, откуда они были взяты. Ни в коем случае разновесы не класть на стол.
6. Сначала надо взять разновес, приблизительно соответствующий весу предмета. Если разновес оказался больше необходимого, то нужно взять следующий за ним и т.д., до тех пор, пока не будет достигнуто равновесие, т.е. приблизительно такое отклонение стрелки в обе стороны от середины шкалы, какое было перед взвешиванием.
Подсчитав общий вес разновесов, записать его в рабочую тетрадь. Не записывать величину навески на отдельных листах, клочках бумаги.
7. Не брать гири из другого набора разновесов.
8. При последовательных взвешиваниях одного или различных предметов, которые производятся в связи с одной работой, следует пользоваться одними и теми же весами и разновесами.
9. После взвешивания весы обязательно арретировать. На весах ничего не оставлять.
Среднеквадратичная ошибка взвешивания
Каждое взвешивание неизбежно сопровождается ошибкой. Поэтому в целях нахождения веса, возможно более приближающегося к истинному, необходимо произвести 4-5 взвешиваний. При последовательных взвешиваниях предмет с весов каждый раз не снимать. Одно взвешивание отделяется от другого только арретированием весов.
Допускаемую при взвешивании ошибку можно выразить в виде средней квадратичной ошибки. Расчет средней квадратичной ошибки производится следующим образом. Допустим, что произведено 1,2, 3… взвешиваний и получены следующие результаты:
а1, а2,.. аn
находим среднее арифметическое из этих значений
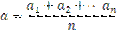
Средняя квадратичная ошибка δ определяется следующим выражением
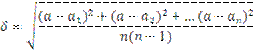
Таким образом, вес предмета равен: А = а ± δ
Задание. Произвести взвешивание на техно-химических весах двух небольших предметов, взятых у лаборанта (весом от 1 до 100 г), с точностью до 0,01 г. Определить среднюю квадратичную ошибку взвешивани
ЛАБОРАТОРНАЯ РАБОТА № 3-4
Получение и исследование свойств наиболее распространенных простых веществ и соединений.
Опыт 1. Получение и свойства водорода
Водород входит в состав кислот, оснований, кислых и основных солей и наиболее распространенного на Земле вещества – воды. Он при- меняется как восстановитель при получении металлов и во многих ор- ганических синтезах. В недалеком будущем водород будет использо- ваться как горючее вместо бензина, керосина, мазута, газа и угля, так как при его горении не образуется вредных примесей. Водород в про- мышленности получают конверсией метана, электролизом воды, а в ла- бораториях – из кислот при их взаимодействии с металлами.
В пробирку поместить 2–3 гранулы цинка и прилить соляной ки- слоты до 1/3 объема пробирки. Выделяющийся водород в течение 3–4 мин собирать в перевернутую вверх дном более широкую пробирку. Не переворачивая пробирку, поднести к ней горящую спичку. Водород за- горается с легким звуком «па».
В отчете написать уравнение реакции цинка с соляной кислотой, указать окислитель и восстановитель, составить электронные схемы окисления и восстановления. Объяснить, почему выделяющийся водо- род необходимо собирать, держа пробирку отверстием вниз. Указать, какие металлы, кроме цинка, можно использовать для получения водо- рода из соляной кислоты.
13
Опыт 2. Получение и свойства кислорода
Кислород – самый распространенный на Земле химический эле- мент: около половины (47 % по массе) вещества земной коры приходит- ся на кислород. Без кислорода невозможна жизнь, так как он поддержи- вает дыхание человека и животных. С его помощью сжигают топливо, получая тепло и электроэнергию. Кислород содержится в воздухе и в химических соединениях – воде, оксидах, гидроксидах, солях, органи- ческих веществах. Для промышленных целей кислород получают рек- тификацией жидкого воздуха, а в лабораториях – из веществ, которые при нагревании разлагаются с его выделением (KMnO4, KClO3, BaO2).
В сухую пробирку поместить два микрошпателя хлората калия KClO3 (бертолетова соль), опустить в неё тлеющую лучинку. Пробирку нагреть на спиртовке. Через некоторое время от начала нагревания тлеющая лучинка вспыхивает. Повторить опыт со смесью бертолетовой соли и оксида марганца (IV), смешанных в соотношении приблизитель- но 4:1 по объему порошков.
В отчете записать уравнение разложения KClO3 и объяснить, поче- му вспыхивает тлеющая лучинка. Объяснить, почему во втором опыте время от начала нагревания пробирки до вспыхивания лучинки меньше, чем в первом. Какую роль во втором опыте играет оксид марганца (IV)?
Опыт 3. Получение и свойства хлора
Самая мрачная страница в истории хлора – применение его в пер- вой мировой войне в качестве боевого отравляющего вещества. Это произошло на одном из западных участков фронта, где англо– французские войска вели сражение с германской армией. Утром 22 ап- реля 1915 года германское командование провело первую в истории войн газовую атаку, выпустив около 180 т хлора. Облако тяжелого ядо- витого желто-зеленого газа поразило более 15 тысяч человек, причем около пяти тысяч – насмерть. Это напоминает, как опасен хлор, поэтому все опыты с ним необходимо проводить только в вытяжном шкафу.
Хлор применяется для отбеливания бумаги и тканей, для получе- ния соляной кислоты и хлорорганических соединений, среди которых наиболее известен поливинилхлорид (ПВХ), используемый для изоля- ции электрических проводов и изготовления деталей радиоаппаратуры.
1. Получение хлора. В сухую пробирку внести два микрошпателя перманганата калия и 20 капель концентрированной соляной кислоты. Наблюдать протекание реакции:
HCl+KMnO4 →MnCl2 +Cl2↑+KCl+H2O 14
В уравнении реакции указать окислитель и восстановитель, напи- сать электронные схемы окисления и восстановления, определить и рас- ставить стехиометрические коэффициенты.
2. Отбеливающие свойства хлора. Три пробирки заполнить на 1/3 объема хлорной водой. В одну поместить лоскутки цветной мате- рии, в другую – окрашенную бумагу, в третью прилить любого органи- ческого красителя. Через некоторое время всё, что было окрашено, обесцвечивается. Отбеливающие свойства хлора объясняются протека- нием двух последовательных реакций:
1) Cl2 + H2O = HCl + HClO (хлорноватистая кислота)
2) HClO = HCl + O (атомарный кислород)
Атомарный кислород – сильнейший окислитель. Он окисляет орга- нические красители и тем самым отбеливает материалы. Этими же ре- акциями объясняется применение хлора для дезинфекции помещений и для обеззараживания водопроводной воды. В отчете показать, у каких элементов изменяется степень окисления в реакциях 1 и 2. К каким ти- пам относятся эти окислительно-восстановительные реакции?
Опыт 4. Получение металлов
Каждый металл вытесняет из растворов солей все другие металлы, расположенные в электрохимическом ряду активности металлов (ряд напряжений металлов) правее его. Это свойство используется для полу- чения многих металлов.
Приготовить три пробирки. В первую пробирку внести 20 капель раствора сульфата меди (II), во вторую – столько же раствора сульфата кадмия, в третью – нитрата свинца (II). В каждую пробирку опустить по одной грануле цинка. Наблюдать протекание реакций с выделением ме- ди, кадмия и свинца на поверхности цинка. В отчете записать уравнения реакций, указать в каждой окислитель и восстановитель, составить электронные схемы окисления и восстановления.
Опыт 5. Получение и свойства оксидов
1. Получение оксида магния. Серебристо-белый легкий металл маг- ний при 500 oС вспыхивает и быстро сгорает ослепительно ярким пла- менем. Горение сопровождается излучением света и выделением боль- шого количества тепла. На сильном выделении света при горении маг- ния основано его применение для изготовления осветительных ракет и в фотографии (магниевая вспышка). Образующийся оксид MgO (жженая магнезия) применяется в медицине как средство от изжоги, как сорбент и катализатор, он входит в состав огнеупорных изделий.
Взять щипцами небольшой кусочек стружки магния и поджечь его пламенем спиртовки. Горящий магний держать над фарфоровой чаш- кой. В чашку с образовавшимся оксидом магния добавить несколько миллилитров воды, размешать стеклянной палочкой и определить среду раствора индикатором фенолфталеином или универсальной индикатор- ной бумагой.
В отчете описать опыт, составить уравнения реакций горения маг- ния и взаимодействия оксида магния с водой, объяснить среду раствора и сделать вывод о химической природе оксида магния.
2. Получение оксида хрома (III) разложением соли. Темно-зеленый оксид хрома Cr2O3 получают разложением гидроксида хрома (III) или хромосодержащих солей. Он применяется в качестве пигмента, катали- затора, полирующего материала, вводится в стёкла для их окраски.
В фарфоровую чашку поместить небольшой горкой кристалличе- ский дихромат аммония и ввести в центр горки горящую спичку. На- блюдать разложение соли, которое вначале идет медленно, а затем убы- стряется. Схема реакции:
(NH)CrO → CrO +N↑+4HO↑ 4227T2322
Описать опыт и указать, какое природное явление он напоминает в уменьшенном масштабе. Переписать схему реакции, составить к ней электронные схемы окисления и восстановления, определить стехио- метрические коэффициенты перед веществами и тип реакции.
Лабораторная работа. №5 СПОСОБЫ ОЧИСТКИ ВЕЩЕСТВ ОТ ПРИМЕСЕЙ
Представление о химических веществах как состоящих из атомов или молекул одного вида является идеализированным. В действитель- ности вещества содержат примеси. Предельное содержание примесей в веществах регламентируется техническими условиями (ТУ) или госу- дарственными стандартами (ГОСТ).
Выпускаемые для широкого использования в промышленности, сельском хозяйстве и в быту химические вещества называются техниче- скими. Для использования в качестве химических реактивов они под- вергаются дополнительной очистке. Химические реактивы по уменьше- нию содержания примесей (повышению степени чистоты) подразделя- ются на чистые (ч), чистые для анализа (чда) и химически чистые (хч).
Развитие новых отраслей техники (космическая радиоэлектроника, атомная энергетика, вычислительная техника и др.) сопровождается не- прерывным повышением требований к чистоте применяемых веществ. Поэтому в дополнение к общепринятым категориям веществ прибави- лась новая группа – вещества особо высокой чистоты (осч).
Декантация – это отстаивание твердых частиц, содержащихся в жидкости, под воздействием силы тяжести. После декантации осветлен- ная жидкость отделяется от осадка твёрдых частиц; при этом происхо- дит очистка от примесей. Достоинство метода – его простота, а недоста- ток – замедленное отстаивание мелких частиц. Значительно быстрее происходит разделение смеси жидких и твердых частиц путем центрифугирования.
Центрифугирование основано на использовании центробежной си- лы, возникающей при быстром вращении. В обычных лабораторных центрифугах скорость вращения составляет около 1000 оборотов в ми- нуту, а в специальных (ультрацентрифугах) – до 6000 об/мин. Искусст- венная сила тяжести в центрифугах превышает земное притяжение в де- сятки-сотни тысяч раз, вследствие чего отстаивание твёрдых частиц происходит за несколько минут.
Фильтрование заключается в пропускании суспензии через порис- тую перегородку – фильтр, задерживающий твердые частицы. Фильт- ром может служить специальная бумага, ткань, пористая керамика, по- ристое стекло, слой песка и другие пористые материалы. При обычных условиях фильтрование идет медленно. Для ускорения его проводят под вакуумом: в приемнике для жидкости с помощью насоса создают раз- режение, вследствие чего на жидкость над фильтром начинает действо- вать атмосферное давление, и чем больше разность давлений (атмо- сферного и в приемнике), тем быстрее идет фильтрование.
Возгонка (или сублимация) – это процесс превращения твердого вещества в пар, минуя жидкое состояние. Возгонкой пользуются тогда, когда основное вещество обладает, а примеси не обладают свойством возгоняться. Возгонкой можно очистить йод, хлорид аммония, серу, нафталин и др. При очистке йода, загрязненного бромом, к нему добав- ляют йодид калия. Бром, взаимодействуя с йодидом калия, образует бромид калия, который не возгоняется.
Перегонка (или дистилляция) применяется для очистки жидкостей от растворенных примесей, а также для разделения жидких веществ с различной температурой кипения. В химических лабораториях перегон- ка применяется для получения дистиллированной воды из водопровод- ной, содержащей примеси солей кальция, магния, железа и др. Про- стейший прибор для перегонки небольших объёмов водопроводной во- ды состоит из колбы Вюрца, холодильника Либиха, аллонжа и прием- ника. Для получения больших объёмов дистиллированной воды исполь- зуются специальные высокопроизводительные установки (опресните- ли), выполненные из нержавеющей стали или из алюминия.
Экстракция – это процесс извлечения растворенного вещества из водного раствора при помощи органического растворителя, не смеши- вающегося с водой. Например, соединения трёхвалентного железа очи- щают от соединений двухвалентного железа экстракцией эфиром, гало- гены из водных растворов экстрагируют бензолом, редкоземельные элементы и некоторые соединения урана – трибутилфосфатом и т.д.
Перекристаллизация применяется для очистки твердых раствори- мых в воде веществ от содержащихся в них примесей. Метод заключа- ется в приготовлении при нагревании насыщенного раствора очищаемо- го вещества с последующим выделением его при охлаждении. Нерас- творимые примеси отделяются на первой стадии – при растворении ос- новного вещества, а растворимые – на второй: при кристаллизации ос- новного вещества они остаются в растворе. Однако незначительное ко- личество примесей при кристаллизации захватывается основным веще- ством за счет адсорбции, поэтому перекристаллизацию повторяют ино- гда несколько раз.
Для отделения (очистки) жидкостей от нерастворимых твердых веществ применяется фильтрование. Фильтрование осуществляется путем пропускания жидкости через пористые материалы – фильтры.
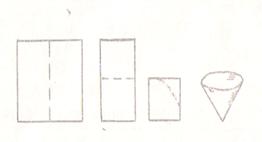 В качестве фильтрующих материалов могут быть использованы – кварцевый песок, асбест, стеклянная вата, фарфоровые пластинки (тигли Гуча), прессованное стекло (тигли Шотта), текстильные ткани, вата, бумажные фильтры (фильтровальная бумага различной плотности). Выбор фильтрующего материала зависит от свойств фильтруемой жидкости, размеров твердых частиц. В лаборатории чаще всего используют бумажные фильтры – простые или складные. Простой фильтр – применяется тогда, когда осадок необходим для дальнейшей работы. Простой фильтр готовят из квадратного листа бумаги, соответствующего по размерам ворони, складывают его пополам (рис. 1), как показано пунктирной линией и еще раз пополам
В качестве фильтрующих материалов могут быть использованы – кварцевый песок, асбест, стеклянная вата, фарфоровые пластинки (тигли Гуча), прессованное стекло (тигли Шотта), текстильные ткани, вата, бумажные фильтры (фильтровальная бумага различной плотности). Выбор фильтрующего материала зависит от свойств фильтруемой жидкости, размеров твердых частиц. В лаборатории чаще всего используют бумажные фильтры – простые или складные. Простой фильтр – применяется тогда, когда осадок необходим для дальнейшей работы. Простой фильтр готовят из квадратного листа бумаги, соответствующего по размерам ворони, складывают его пополам (рис. 1), как показано пунктирной линией и еще раз пополам
Рис. 1
Внешние углы обрезают по дуге с таким расчетом, чтобы край фильтра был ниже края воронки на 0,5-1 см. Отворачивают одну четвертую часть сложенного фильтра и вставляют в воронку, прижимают пальцами к стенкам воронки, смачивая дистиллированной водой. Необходимо, чтобы фильтр плотно прилегал к станкам воронки.
Складчатый фильтр. Внимательно ознакомьтесь с изготовлением складчатого фильтра (рис. 2). Проверьте правильность ваших умений по изготовлению складчатого фильтра у преподавателя.
Рис. 2
Для легко фильтрующихся жидкостей применяется фильтрование под обычным давлением, трудно фильтруемых – фильтрование под вакуумом. Для вязких жидкостей и насыщенных растворов – горячее фильтрование.
Дата добавления: 2018-04-05; просмотров: 669; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
