Примеры решения типовых задач
Пример № 1. Напишите структурные формулы изомеров, соответствующие эмпирической формуле С4Н8, и дайте им названия.
Решение:Изомерия алкенов обусловлена положением двойной связи и разветвлённостью углеродного скелета:

Однако той же структурной формуле соответствуют циклоалканы:

Таким образом, эмпирической формуле С4Н8 соответствуют пять изомеров.
Пример № 2. При крекинге бутана объёмом 3,36 л (н.у.) образуются этан и этилен. Рассчитайте массу бромной воды (массовая доля Br2 1,6 %), которую могут обесцветить продукты крекинга.
Решение:
1. Рассчитайте количество вещества бутана, подвергнутого крекингу:
n(C4H10) =  ;
;
n(C4H10) =  = 0,15 моль
= 0,15 моль
2. Составьте уравнение реакции термического разложения (крекинга) бутана:
С4Н10  С2Н6 + С2Н4
С2Н6 + С2Н4
Из уравнения реакции следует:
n(C2H4) = n(C4H10); n(С2Н4) = 0,15 моль
3. С бромной водой реагирует только этилен:
С2Н4 + Br2 ® С2Н4Br2
На основании этого уравнения записываем:
n(Br2) = n(С2Н4); n(Br2) = 0,15 моль
4. Вычислите массу брома, требуемого для реакции:
m(Br2) = n(Br2) × M(Br2); m(Br2) = 0,15 × 160 = 24 г
5. Рассчитайте массу бромной воды, которую может обесцветить образовавшийся при крекинге бутана этилен:
m(бромной воды) =  ;
;
m(бромной воды) =  = 1500 г = 1,5 кг
= 1500 г = 1,5 кг
Ответ: 1,5 кг.
Пример № 3. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 2,8 г присоединил бром массой 8 г. Определите формулу алкена и назовите его.
|
|
|
Решение:
1. Вычислите количество вещества брома, участвующего в реакции:
n(Br2) =  ; n(Br2) =
; n(Br2) =  = 0,05 моль
= 0,05 моль
2. Составьте уравнение реакции бромирования алкена:
CnH2n + Br2 ® CnH2nBr2
Из уравнения реакции следует:
n(CnH2n) = n(Br2); n(CnH2n) = 0,05 моль
3. Вычислите молярную массу алкена:
М(CnH2n) =  ; М(CnH2n) =
; М(CnH2n) = 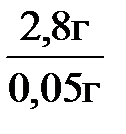 = 56 г/моль
= 56 г/моль
4. Молярная масса алкена равна:
М(CnH2n) = n∙М(C) + 2n∙М(H);
М(CnH2n) = (n× 12 + 2n×1) г/моль = 14n г/моль
5. Получаем уравнение: 14n = 56, находим n = 4, т.е. формула алкена С4Н8 (бутен). Известно, что алкен имеет нормальное строение и содержит двойную связь при первом атоме углерода, записываем его структурную формулу: СН2 = СН – СН2 – СН3 – бутен – 1.
Пример № 4. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение: Запишем уравнения реакций:
СnН2n + НСl → СnН2n+1Сl,
CnH2n+1Cl + NaOH → CnH2n+1OH + NaCl.
n(HCl) = 6,72/22,4 = 0,3 моль.
Согласно уравнениям реакций, n(CnH2n+1OH) = n(CnH2n+1Cl) = n(HCl) = 0.3 моль.
Молярная масса спирта равна: M(CnH2n+1OH) = 22,2/0,3 = 74 г/моль, откуда
n = 4. Следовательно, молекулярная формула спирта – С4Н9ОН.
|
|
|
Из четырёх спиртов состава С4Н9ОН только третичный спирт
(2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвлённый углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвлённый скелет. Это 2-метилпропен.
Уравнения реакций:

Ответ: 2-метилпропен; трет-бутанол.
Пример № 5 . Смесь этана и этилена объёмом 3 л пропустили через поглотительную склянку, содержащую 200 мл 3 %-ной бромной воды (d = 1,02 г/мл). При этом образовалось 4,7 г дибромэтана. Рассчитайте состав смеси углеводородов в объемных процентах.
Решение: Начнём с анализа химической сущности задачи. С бромной водой реагируют углеводороды, содержащие кратные связи.
Предельные углеводороды в этих условиях в реакцию не вступают:
C2H6 + Br2(aq) =/=
(1) C2H4 + Br2(aq) → C2H4Br2
1 моль → 1 моль → 1 моль
Количество брома, израсходованного в реакции (1), рассчитывается следующим образом:
n(Br2) = n(C2H4Br2) = m(C2H4Br2) / M(C2H4Br2) = 4,7 г : 188 г/моль = 0,025 моль
Общее количество брома в исходной бромной воде (по условию задачи) таково:
n(Br2) = m(Br2) / M(Br2) = {V ∙d ∙w} : M(Br2) =
= {200 мл ∙ 1,02 г/мл ∙ 0,03} : 160 г/моль = 0,038 моль.
Поскольку 0,038 моль > 0,025 моль, бром в поглотительной склянке взят в избытке. Следовательно, весь этилен вступил в реакцию (1).
Рассчитаем количество этилена, а затем − его объём:
n(C2H4) = n(Br2) = 0,025 моль;
V(C2H4) = n(C2H4) ∙VM = 0,025 моль ∙ 22,4 л = 0,56 л,
отсюда объёмные доли этана и этилена j1 и j2будут равны:
j2 = {V(C2H4) / V(смеси)} 100 % = {0,56 л / 3 л} 100 % = 18,67 %
|
|
|
j1 = 100 % − 18,67 % = 81,33 %
Ответ: j1(C2H6) = 81,33 %; j 2 (C2H4) = 18,67 %.
Пример № 6. У продукта присоединения брома к непредельному углеводороду плотность по водороду равна 94. Установите формулу этого соединения.
Решение:На первый взгляд, задача кажется абсолютно нерешаемой: почти никаких исходных данных, а нужно установить формулу вещества. Ведь существует множество гомологических рядов непредельных углеводородов, содержащих двойные и тройные связи. С какой стороны подойти к решению?
Вспомним, что непредельные соединения при реакции с галогенами превращаются в алкилгалогениды с общей формулой CxHyBr2z. Теперь, зная плотность этого алкилгалогенида по водороду D(H2), найдём его молярную массу:
M(CxHyBr2z) = 2 г/моль ∙D(H2) = 2 г/моль ∙ 94 = 188 г/моль
Молярная масса углеводорода CxHy равна разности:
M(CxHy) = M(CxHyBr2z) − 2z∙ M(Br) = 188 г/моль − 2z∙ 80 г/моль,
причём очевидно, что z может быть равно только 1, иначе значение 2z∙∙80 станет больше, чем M(CxHyBr2z). Таким образом:
|
|
|
M(CxHyBr2z) = 188 г/моль − 2 ∙ 80 г/моль = 28 г/моль.
Такой молярной массе соответствует этилен C2H4. Следовательно, искомое соединение имеет формулу C2H4Br2.
Ответ: C2H4Br2.
Пример № 7. С помощью каких химических реакций можно очистить пропан от примеси пропена?
Решение: Пропен можно поглотить бромной водой:
СН3-СН=СН2 + Вr2 → СН3-СНВr-СН2Вr
или водным раствором перманганата калия:
СН3-СН=СН2 + [О] + Н2О = СН3-СН(ОН)-СН2ОН.
Пропан с этими веществами не реагирует и улетучивается.
Пример № 8. Этиленовый углеводород массой 7,0 г присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
Решение: Этиленовые углеводороды присоединяют бромоводород по уравнению: CnH2n + HBr = CnH2n+1Br
n(HBr) = 2,24/22,4 = 0,1 моль. n(CnH2n) = n(HBr) = 0,1 моль.
M(CnH2n) = 7,0/0,1 = 70 г/моль, следовательно, n = 5.
Существует 5 структурных изомеров этиленовых углеводородов состава С5Н10:

Из этих веществ только пентен-2 имеет цис-транс-изомеры:

Ответ:Цис-пентен-2.
Пример № 9 . Сколько существует индивидуальных веществ состава С3Н5Сl, обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ.
Решение: С3Н5Сl –это монохлорпроизводное от углеводорода С3Н6. Это вещество обесцвечивает бромную воду, следовательно, имеет в своём составе двойную связь. Три атома углерода могут образовать только неразветвлённый углеродный скелет с концевой двойной связью: С − С = С.
Структурная изомерия возможна только за счет положения атома хлора относительно двойной связи:
СН3-СН = СНСl; СН3-ССl = СН2; Сl-СН2-СН = СН2
1-хлорпропен 2-хлорпропен 3-хлорпропен
1-хлорпропен может существовать в виде цис-транс-изомеров:

Ответ:4 изомера.
Пример № 10 . При взаимодействии 11,2 л (н.у.) смеси изомерных углеводородов, представляющих собой газы с плотностью по водороду 21, с бромной водой получено 40,4 г соответствующего дибромпроизводного. Определите строение этих углеводородов и содержание каждого из них в смеси (в % по объёму).
Решение: Молярная масса изомерных углеводородов равна:
M(СхНу) = 21∙ 2 = 42 г/моль, следовательно, углеводороды имеют формулу С3Н6. Такую молекулярную формулу имеют два вещества − пропен и циклопропан. Пропен реагирует с бромной водой:
СН3 - СН = СН2 + Вr2 = СН3 – СНВr - СН2Вr
Молярная масса дибромпроизводного равна: М(С3Н6Вr2) = 202 г/моль, а его количество: n(C3H6Br2) = 40,4/202 = 0,2 моль. Следовательно, в исходной смеси было 0,2 моль пропена. Общее количество углеводородов в смеси было равно 11,2/22,4 = 0,5 моль; оставшиеся 0,3 моль приходятся на долю циклопропана, который не взаимодействует с бромной водой.
Объёмные доли газов в смеси равны их мольным долям:
j (пропена) = 0,2/0,5 = 0,4, или 40 %, j (циклопропана) = 0,6, или 60 %.
Ответ:40 % пропена, 60 % циклопропана.
Пример № 11 . При пропускании алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше массы алкена. Установите формулу алкена.
Решение: Алкены окисляются водным раствором перманганата калия по общему уравнению:
ЗСnН2n + 2KМnO4 + 4Н2O = 3CnH2n(OH)2 + 2MnO2 + 2KOH
Из 3 моль алкена массой 3(12n+2n) = 42n образуется 2 моль МnО2
(массой 2∙87 = 174 г).
По условию задачи: 42n – 2,07 = 174, откуда n = 2.
Искомый алкен – этилен.
Ответ:С2Н4.
Дата добавления: 2018-04-05; просмотров: 1079; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
