Примеры решения типовых задач
Nbsp;
СБОРНИК ЗАДАЧ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
Учебное пособие
ОГЛАВЛЕНИЕ
Введение………………………………………………………………………….4
1. Углеводороды……………………………………………………………….. ….5
1.1. Алканы…………………………………………………………........................5
1.2. Непредельные углеводороды……………………………………………….21
1.2.1. Алкены, диены……………………………………………………………….21
1.2.2. Алкины………………………………………………………………….. ….38
1.3. Ароматические углеводороды…………………………………………….49
2. Кислородосодержащие органические соединения…………....................71
2.1. Спирты…………………………………………………………...................71
2.2. Альдегиды и кетоны………………………………………………………..87
2.3. Карбоновые кислоты и их производные………………………………..100
2.3.1. Сложные эфиры карбоновых кислот……………………………………...114
3. Азотсодержащие органические соединения…………………………........129
3.1. Нитросоединения……………………………………………………….. .. 129
3.2. Амины…………………………………………………………................ .. 131
4. Аминокислоты. Пептиды. Белки………………………………………142
5. Углеводы………………………………………………………………….153
Литература……………………………………………………………………….169
ВВЕДЕНИЕ
Органическая химия является одним из важнейших разделов химической науки. Без глубоких знаний основ органической химии невозможно стать хорошим специалистом в области предупреждения и ликвидации последствий чрезвычайных ситуаций, возникающих в техносфере. Необходимо также знание той потенциальной опасности, которую таят в себе многие органические соединения для биосферы.
|
|
|
Данное учебное пособие имеет цель – помочь курсантам командно-инженерного факультета и студентам очной и заочной форм обучения инженерного факультета Академии гражданской защиты МЧС России полнее осмыслить теоретические основы органической химии и проверить, в какой степени они усвоены.
В учебном пособии рассмотрены основные классы органических соединений: углеводороды, кислородосодержащие соединения (спирты, альдегиды и кетоны, карбоновые кислоты и их производные), азотсодержащие органические соединения (нитросоединения, амины и аминокислоты), углеводы и белки.
В каждом разделе приведены: теоретическое введение, примеры решения типовых задач и задачи для самостоятельной работы, направленной на закрепление полученных знаний.
УГЛЕВОДОРОДЫ
АЛКАНЫ
АЛКАНЫявляются насыщенными или предельными углеводородами,
так как все свободные валентности атомов углерода заняты (полностью насыщены) атомами водорода.
Общая формула гомологического ряда CnH2n+2.
|
|
|
Первые четыре представителя ряда насыщенных углеводородов (алканов) имеют названия: метан, этан, пропан, бутан. Названия следующих углеводородов образуются из названий греческих числительных и окончания -ан. Углеводороды с прямой цепью называют нормальными или неразветвлёнными.
Гомологический ряд метана
| Название углеводорода | Формула | Название углеводорода | Формула |
| Метан | 
| Гексан | 
|
| Этан | 
| Гептан | 
|
| Пропан | 
| Октан | 
|
| Бутан | 
| Нонан | 
|
| Пентан | 
| Декан | 
|
Если от молекулы предельного углеводорода отнять один атом водорода, то остаток называется радикалом, или алкилом. Название радикала образуют из названия соответствующего углеводорода, заменяя окончание -ан на -ил.
| Важнейшие радикалы алканов (алкилы) | |||
| Формула | Название | Формула | Название |

| метил | 
| этил |

| пропил | 
| бутил |

| изопропил | 
| изопентил (изоамил) |

| трет-бутил | 
| изобутил |

| неопентил | 
| пентил (амил) |

| втор-бутил | 
| трет-пентил |
Основной вид изомерии – изомерия углеродного скелета. Число возможных изомеров с ростом числа n резко увеличивается.
Например, для бутана известно два изомера
|
|
|

Для пентана (С5Н12) – три
Для гексана (С6Н14) – пять

Для нонана (С9Н20) – тридцать пять.
По международной заместительной номенклатуре ИЮПАК основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители.
1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной цепи:
– главной цепью углеродных атомов считают самую длинную;
– если в углеводороде можно выделить две или несколько одинаково длинных цепей, то за главную выбирают ту из них, которая имеет наибольшее число разветвлений.
2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца цепи, к которому ближе примыкает любой из алкилов. Если разные алкилы находятся на равном удалении от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т. д.).

Если же одинаковые радикалы, определяющие начало нумерации, находятся на равном удалении от обоих концов цепи, но с одной стороны их имеется большее число, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше.
|
|
|
Называя соединение, сначала перечисляют заместители в алфавитном порядке (числительные не принимают во внимание), причём перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород, соответствующий главной цепи углеродных атомов, отделяя слово от цифр дефисом.
Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д.) и ставят перед названием этих радикалов, а их положение указывают, как обычно, цифрами, причём цифры разделяют запятыми, располагая в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. Для простейших углеводородов изостроения сохраняются их несистематические названия (изобутан, изопентан, неопентан, изогексан).
В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми.

Получение
1. Из ненасыщенных углеводородов (гидрирование)

2. Из галогенпроизводных углеводородов (реакция Вюрца)

3. Получение метана:
а) при температуре электрической дуги

б) из карбида алюминия

в) из солей карбоновых кислот

Химические свойства
Химическая устойчивость алканов объясняется высокой прочностью
s-связей С−С и С−Н.
Для алканов характерны радикальные реакции:
1. Галогенирование

2. Нитрование

3. Изомеризация

4. Крекинг – гомолитический разрыв С−С связи:

5. Окисление

На воздухе алканы сгорают до углекислого газа и воды

Примеры решения типовых задач
Пример № 1. Напишите структурную формулу 2,2,5,5-тетраметилгексана. Напишите формулу его изомера, имеющего в качестве заместителей при основной цепи только этильные радикалы.
Решение:
Структурная формула 2,2,5,5-тетраметилгексана:

В качестве изомера с этильными радикалами можно взять углеводород, имеющий 6 атомов углерода в главной цепи и два этильных заместителя в положениях 3 и 4, т.е. 3,4-диэтилгексан:

Пример № 2. Запишите уравнения реакций, при помощи которых можно из метана и неорганических веществ получить бутан.
Решение:
1. Хлорированием метана получают хлорметан (хлористый метил):
CH4 + Cl2 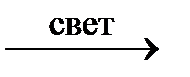 CH3Cl + HCl
CH3Cl + HCl
2. При нагревании хлорметана с натрием образуется этан (реакция Вюрца):
2CH3Cl + 2Na  CH3 – CH3 + 2NaCl
CH3 – CH3 + 2NaCl
3 . При хлорировании этана получают:
CH3 – CH3 + Cl2 
 + HCl
+ HCl
4. Бутан получают из галогенпроизводного этана по реакции Вюрца:
2C2H5Cl + 2Na ® CH3 – CH2 – CH2 – CH3 + 2NaCl
Пример № 3. Рассчитайте массу тетрахлорида углерода, который можно получить при хлорировании метана объёмом 11,2 л молекулярным хлором, объём которого в реакционной смеси равен 56 л (н.у.). Выход продукта составляет 70 % от теоретически возможного.
Решение:Записываем уравнение реакции хлорирования метана до тетра-
хлорида углерода: CH4 + 4Cl2 ® CCl4 + 4HCl
Определяем количества исходных веществ:
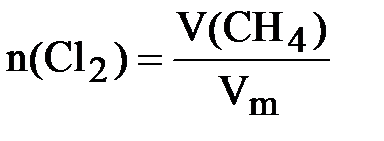 ;
; 
 ;
; 
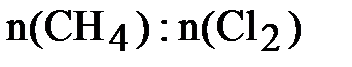 = 0,5 : 2,5 = 1:5,
= 0,5 : 2,5 = 1:5,
следовательно, хлор взят в избытке. Все дальнейшие расчёты проводим по метану, взятому в недостатке:  = 0,5 моль.
= 0,5 моль.
Определяем массу CCl4, который может быть получен при количественном выходе:
m(CCl4) = n(CCl4) ×M(CCl4) = 0.5 × 154 = 77 г
Учитывая, что выход продукта составляет 70 % от теоретически возможного, находим массу полученного CCl4:
 ;
;  г
г
Ответ: 53,9 г.
Пример № 4. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
Решение:Так как в результате горения вещества образуются СО2 и Н2О, то в состав соединения входят углерод, водород и, возможно, кислород.
1. Определяем количества (моль) оксида углерода (IV) и воды, образовавшихся в результате горения:
n(CO2) =m/M = 13,2/44 = 0,3; n(H2O)= m/M = 5,85/18 = 0,325
2. Определяем количества атомов углерода и водорода, которые содержались в исходном соединении:
n(C) = n(CO2) = 0,3 моль
n(H) = 2 ∙n(H2O) = 2 ∙ 0,325 = 0,65 моль
3. Определяем массы углерода и водорода:
m(C) = n(C).∙M(C) = 0,3 ∙ 12 = 3,6 г.
m(H) = n(H) ∙ M(H) = 0,65 г
4. Суммарная масса углерода и водорода:
m(C) + m(H) = 3,6 + 0,65 = 4,25 г,
т.е. равна массе исходного вещества, следовательно, вещество не содержит кислорода (является углеводородом состава СхНу).
5. Определяем соотношение углерода и водорода:
n(C). : n(H) = 0,3 : 0,65
6. Определяем молярную массу вещества:
М(СхНу) = 29.Dвозд. = 29 ∙ 5,862 = 170 г/моль
Молярную массу можно представить в виде:
М(СхНу) = 12х + у = 170.
7. Решаем систему уравнений:
n(C) : n(H) = 0,3 :0,65
М(СхНу) = 12х + у = 170
Находим, что х = 12, а у = 26. Формула углеводорода С12Н26.
Пример № 5. Определить формулу вещества, если оно содержит 84,21 % углерода и 15,79 % водорода, и имеет относительную плотность по воздуху, равную 3,93.
Решение:1. Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса H - 15,79 г.
2. Найдём количество вещества каждого атома:
n(C) = m / M = 84,21 / 12 = 7,0175 моль,
n(H) = 15,79 / 1 = 15,79 моль.
3. Определяем мольное соотношение атомов С и H:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула – С4Н9.
4. По относительной плотности рассчитаем молярную массу:
М = D(возд.) ∙ 29 = 114 г/моль.
6. Молярная масса, соответствующая простейшей формуле С4Н9 равна
57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула – С8Н18.
Пример № 6. 448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение: Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2.
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
1. При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция − 8 г, молярная масса карбоната кальция 100 г/моль. Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
2. Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана − С4Н10.
Этой формуле соответствуют два изомера – н-бутан и 2-метилпропан:

Ответ: общая формула алкана − С4Н10
Пример № 7. Углеводород имеет элементный состав: 82,76 % углерода и 17,24 % водорода (по массе). При хлорировании (радикальном) углеводород образует два изомерных монохлорида − первичный и третичный. Определите строение исходного углеводорода.
Решение:Пусть формула углеводорода − СхНу (М = 12x+y). Массовая доля водорода в одном моле этого вещества равна: w(H) = y/(12x+y) = 0,1724, откуда, y = 2,5x. Это означает, что простейшая формула углеводорода С2Н6.
Ей соответствует истинная формула С4Н10. Существует два углеводорода состава С4Н10:

Третичные атомы углерода есть только в одном из этих двух изомеров, в 2-метилпропане, поэтому только 2-метилпропан при хлорировании может образовать третичный алкилхлорид:

Ответ: 2-метилпропан.
Пример № 8. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода.
Решение: При сгорании одного моля углеводорода, содержащего nатомов углерода, образуется n моль СО2:
СnН2n+2 + (3n+1)/2O2 → СO2 + (n+1)Н2О
При пропускании СО2 через известковую воду образуется карбонат кальция:
Са(ОН)2 + СО2 = СаСО3 + Н2О; v(СаСО3) = 60/100 = 0,6 моль = n(CO2).
При сгорании 0,1 моль СnН2n+2 выделилось 0,6 моль СО2, следовательно
n = 6. Молекулярная формула углеводорода - С6Н14.
Из пяти углеводородов состава С6Н14 четвертичный атом углерода есть только в 2,2-диметилбутане:

Пример № 9. При пропускании 11,2 л смеси метана, оксида углерода (IV) и оксида углерода (II) через раствор гидроксида натрия, взятый в избытке, объём исходной смеси уменьшился на 4,48 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода. Определите состав исходной смеси (в % по объёму).
Решение: При пропускании смеси через раствор щёлочи поглощается только оксид углерода (IV): СО2 + 2NaOH = Na2CO3 + Н2О
Объём поглощенного СО2 составляет 4,48 л.
Следовательно, n(CO2) = 4,48/22,4 = 0,2 моль. После поглощения CO2 объём смеси составил 11,2−4,48 = 6,72 л, что соответствует 0,3 моль. Оставшиеся газы сгорают по уравнениям:
СН4 + 2О2 = СО2 + 2Н2О; 2СО + О2 = 2СО2
Пусть в смеси было x моль СН4 и у моль СО, тогда на сгорание СН4
израсходовано 2x моль О2, а на сгорание СО − у/2 моль O2; всего израсходовано 6,72/22,4 = 0,3 моль О2. Имеем систему:
x + у = 0,32
2x + у/2 = 0,3;
Отсюда x = 0,1, у = 0,2. Значит, в исходной смеси было 0,1 моль СН4 (2,24 л, или 20 %), 0,2 моль СО (4,48 л, или 40 %) и 0,2 моль СO2 (4,48 л, или 40 %).
Ответ: 20 % СН4;40 % СО;40 % СО2
Дата добавления: 2018-04-05; просмотров: 911; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
