Антибиотикорезистентность микроорганизмов
Nbsp;
Последовательность операций при включении чужеродного гена в векторную молекулу. Перенос вектора с чужеродным геном в микробную клетку. Компетентные клетки.
Технология рекомбинантных ДНК (также молекулярное клонирование, или генная инженерия) - это совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала (ДНК) из одного организма в другой. В настоящее время можно вырезать отдельные участки ДНК, получать нуклеотиды на ДНК-синтезаторах (приборах для автоматического химического синтеза ДНК) практически в неограниченном количестве, определять последовательность нуклеотидов (разделяя, секвенируя их) сотнями в сутки, изменять выделенный ген, вводить его вновь в геном культивируемых клеток или эмбриона животного, где этот измененный ген начинает функционировать. Эксперименты с рекомбинантными ДНК используют крупномасштабно в промышленном производстве БАВ. Эксперименты по клонированию включают следующие этапы:
1. Рестриктазное расщепление из организма-донора нужных генов нативной ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК).
2.Быстрая расшифровка всех нуклеотидов в очищенном фрагменте ДНК, позволяющая определить точные границы гена и аминокислотную последовательность, кодируемую геном.
3. Обработка рестрикционными эндонуклеазами вектора для клонирования, который может реплицироваться в клетке-хозяине.
|
|
|
4. Сшивание ДНК-лигазой двух фрагментов ДНК с образованием новой рекомбинантной молекулы - конструкция «клонирующий вектор - встроенная ДНК».
5. Введение этой конструкции в клетку хозяина (реципиента), где она реплицируется и передается потомкам. Этот процесс называется трансформацией. После трансформации бактериальная клетка воспроизводит фрагмент клонируемой ДНК миллионами идентичных клеток.
6. Идентификация и отбор клеток, несущих рекомбинантную ДНК (трансформированные клетки).
7. Получение специфичного белкового продукта, синтезированного клетками-хозяевами (рис. 6).
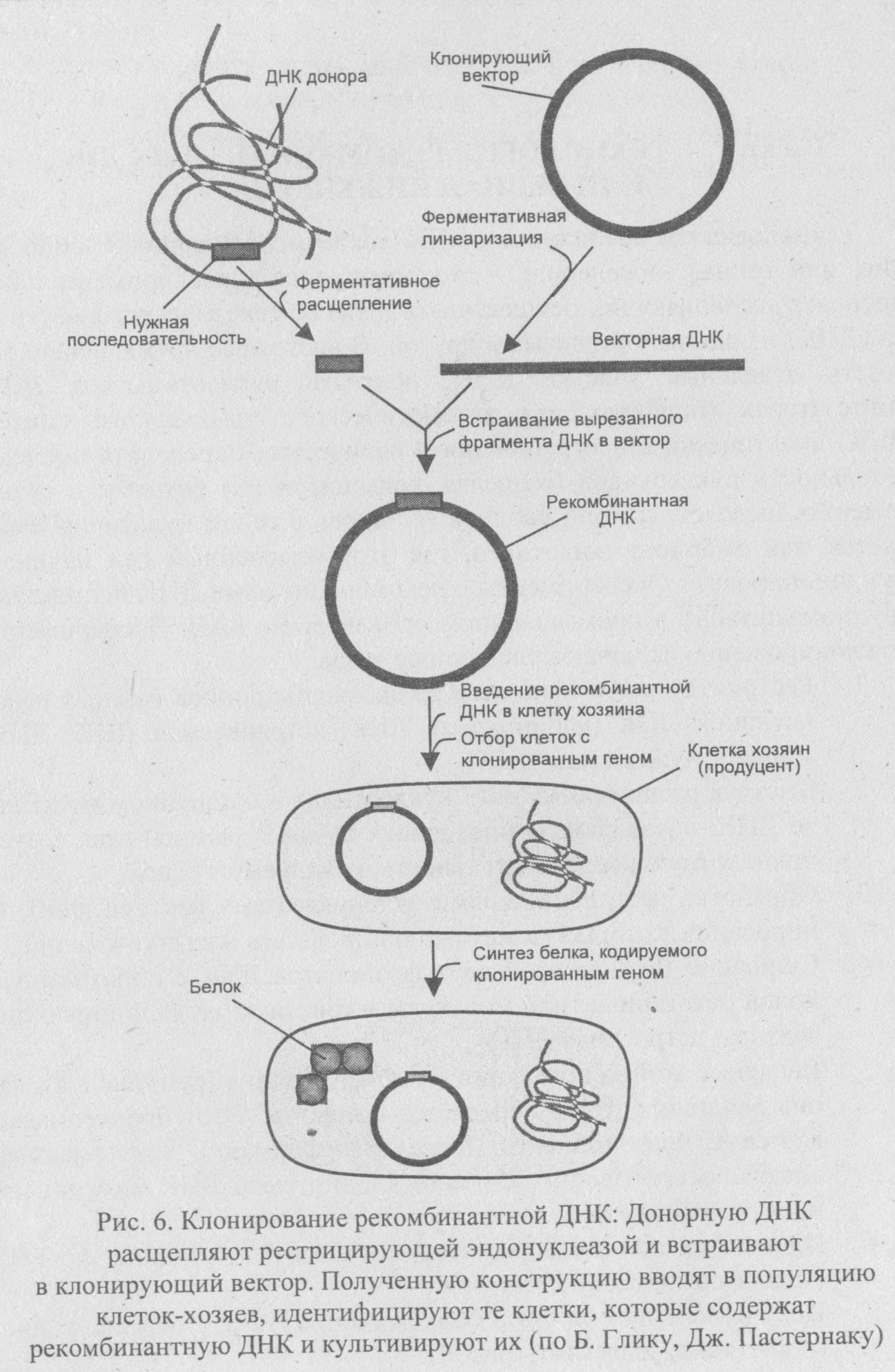
Конструирование рекомбинантных молекул осуществляется с помощью ряда ферментов — обязательного и незаменимого инструмента практически всех этапов этого сложного процесса, прежде всего ферментов рестрикции (рестрицирующих эндонуклеаз, рестриктаз). Рест-риктазы являются составной частью системы рестрикции — модификации прокариотических клеток. Эта система связана с защитой клеток от проникновения чужеродной ДНК. Система модификации осуществляет метилирование собственной ДНК в сайтах ее узнавания немедленно после репликации; чужеродную ДНК, проникающую в клетку, бактерии гидролизуют с помощью рестриктаз.
|
|
|
Различают три основных класса рестриктаз. Рестриктазы класса I разрывают молекулы ДНК в произвольных точках, рестриктазы I и III классов обладают метилирующей и эндонуклеазной активностью. Ферменты II класса, которые и используются в генной инженерии, состоят из двух отдельных белков: рестрикционной эндонуклеазы и модифицирующей метилазы.
В настоящее время используется свыше 400 различных рестриктаз. Эти ферменты синтезируют самые разнообразные микроорганизмы. Для их культивирования необходимы оптимальные условия (температура, состав и рН среды, концентрация кислорода и т.д.). С целью повышения продуктивности и стандартизации процесса получения этих ферментов клонируют гены рестрицирующих эндонуклеаз в Е. соli.
Рестриктазы узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК. При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходило в строго определенных участках (сайтах). Каждый фермент рестрицирующих эндонуклеаз «опознает» в ДНК специфическую последовательность из 4-6 нуклеотидов. Многие рестрицирующие эндонуклеазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов, располагаясь наискось друг от друга. Б результате образуются одноцепочечные комплементарные концы с «хвостами» из 4-х нуклеотидов в каждом («липкие» концы). Кроме рестриктаз, расщепляющих нуклеотидную цепь с образованием липких концов, существуют рестриктазы, вносящие разрывы в цепи строго друг против друга с образованием ДНК с «тупыми концами».
|
|
|
Одних ферментов рестрикции при молекулярном клонировании недостаточно, так как водородные связи между теми четырьмя основаниями, которые образуют липкие концы, не столь прочны, чтобы удержать два объединившихся фрагмента ДНК. Для устранения разрыва в сахарофосфатном остове молекулы служит фермент ДНК-лигаза, катализирующий образование фосфодиэфирных связей между концами по-линуклеотидных цепей, которые удерживаются вместе при спаривании липких концов. ДНК-лигаза сшивает и тупые концы.
Таким образом, одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, другая — содержит информацию, необходимую для репликации в клетке рекомбинантной ДНК. Кроме того, при ДНК-рестрикции образуются разнообразные фрагменты и после их лигирования (соединения фосфодиэфирной связью) с векторной ДНК появляется множество различных комбинаций фрагментов, например, объединяющих между собой фрагменты донорной ДНК и векторные ДНК. Для уменьшения количества последних рестрицированную векторную ДНК обрабатывают щелочной фосфатазой.
|
|
|
Для введения рекомбинантной ДНК применяют два основных вектора:
1) Плазмиды.
2) Бактериофаги.
Плазмиды представляют собой внехромосомный генетический элемент в виде кольцевых молекул ДНК, содержащих 1-3% генома бактериальной клетки. Плазмиды есть у всех бактерий. Одни из них содержат информацию, обеспечивающую их собственный перенос из одной клетки в другую (Р-плазмиды), другие - несут гены устойчивости к антибиотикам (R-плазмиды) или специфические наборы генов, ответственных за утилизацию метаболитов (плазмиды деградации). Каждая плазмида содержит сайт начала репликации, без которого репликация плазмиды в клетке-хозяине невозможна. Если две или более плазмиды не могут сосуществовать в одной и той же клетке — они принадлежат к одной группе несовместимости. Плазмиды, относящиеся к разным группам несовместимости, беспрепятственно существуют в одной клетке независимо от числа копий. У некоторых микроорганизмов в одной клетке обнаружено до 10 разных плазмид, каждая из которых выполняла свои функции и относилась к своей группе несовместимости. Репликация плазмид идет независимо от репликации хромосом. Количество копий определяется регуляторной системой клетки.
Таким образом, плазмиды обладают свойствами, позволяющими использовать их в качестве вектора для переноса клонируемой ДНК. Бактериальный клон, содержащий такую плазмиду, можно сравнить с фабрикой по производству этого фрагмента.
Плазмидные векторы, как правило, создают методом генной инженерии, так как природные (немодифицированные) плазмиды лишены ряда обязательных для «высококачественного вектора» свойств:
• небольшого размера, так как эффективность переноса экзогенной ДНК в Е. соli снижается при длине плазмиды более 15 тысяч пар нуклеотидов;
• наличия сайта рестрикции, в который осуществлена вставка;
• наличия одного или более селективных генетических маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК.
Вводят плазмиды в соматические клетки с помощью химических реагентов, повышающих проницаемость клеточной оболочки. В частности, чтобы обеспечить проникновение в клетки плазмидной ДНК, их обрабатывают ледяным раствором кальция хлорида, затем выдерживают при 42 °С в течение 1,5 мин. Эта обработка приводит к локальному разрушению клеточной стенки. Максимальная частота трансформации - 10 , т.е. на каждую тысячу клеток приходится одна трансформированная. Частота трансформации не бывает 100%-й, затем используют схемы отбора, позволяющие идентифицировать трансформированные клетки.
В качестве маркеров плазмида может содержать гены, определяющие устойчивость бактерии к антибиотикам. Вставка чужеродного (до-норного) гена в маркерный ген приводит к инактивации последнего. Это позволяет отличать трансформированные клетки, получившие векторную плазмиду (утратившие устойчивость к антибиотику), от клеток, получивших рекомбинантную молекулу (сохранивших устойчивость к одному, но утративших устойчивость к другому антибиотику). Этот прием называется инактивацией маркера вставки.
Для отбора трансформированных клеток, содержащих рекомбинантную ДНК (гибридную плазмиду), проводят тестирование на рези-стентность к определенным антибиотикам. Например, клетки, несущие гибридную плазмиду, устойчивы к ампициллину, но чувствительны к тетрациклину (в маркерный ген которого и внедрена донорная ДНК).
Процесс разделения геномной ДНК на клонируемые элементы и введения этих элементов в клетки-хозяева называется созданием геномной библиотеки (банка клонов, банка генов).
Все системы клонирования должны отвечать двум основным требованиям:
1)Наличию нескольких сайтов для клонирования;
2) Возможности достаточно простой идентификации клеток с ре-комбинантными ДНК.
Для всех рутинных процедур молекулярного клонирования широко используется Е. соli в качестве клетки-хозяина. Клетки, способные поглощать чужеродную ДНК, называются компетентными; компетентность Е.соli повышают, используя специальные условия культивирования. Для получения больших количеств чужеродных белков с помощью рекомбинантных штаммов Е. соli была сконструирована плазмида, содержащая сильный промотор, селективный маркерный ген и короткий участок с несколькими уникальными сайтами для рестрицирующих ферментов - полилинкер.
Эффективными методами трансформации Е. соН плазмидами является электропорация (воздействие на клеточные мембраны электрическим током для увеличения их проницаемости). Для введения клонированных генов в соматические клетки также применяют микроинъекции и микроукалывания или слияние с клеткой нагруженных ДНК мембранных везикул (липосом).
Использование бактериофагов в качестве носителей генетической информации основано на том, что рекомбинантный ген встраивается в геном вируса ив последующем реплицируется с генами вируса при размножении в инфицированной клетке-хозяина. С этой целью применяют бактериофаг ^.-вирус с двухцепочечной ДНК, которая после проникновения в клетку смыкается в кольцо. Бактериофаг М-13 - вирус нитевидной формы с кольцевой замкнутой ДНК, которая в клетке превращается в двухцепочечную и реплицируется в клетках-потомках. В поисках эукариотических систем экспрессии, для получения биологически активных белков, созданы бакмиды - экспрессирующие векторы на основе бакуловирусов для Е. соН и клеток насекомых. Выход рекомбинантных бакуловирусов в такой системе повысился до 99%. Клетки насекомого, инфицированные бакуловирусами, синтезировали гетероло-гичный белок. Векторы на основе фага удобны для создания клонеток (банка генов), но не для тонких манипуляций сфрагментом ДНК. Для детального изучения и преобразования фрагменты ДНК переклонируют в плазмиды.
Кроме указанных векторов в генной инженерии применяют косми-ды - плазмиды, несущие соs-участок (комплементарные липкие концы) ДНК фага X. Наличие соs-участка позволяет производить упаковку ДНК в головку фага in vitro, что обеспечивает возможность их введения в
клетку путем инфекции, а не трансформации. Фазмиды - гибриды между фагами и плазмидами - способны развиваться как фаг и как плаз-мида. Уступая космидам по клонирующей емкости, фазмиды дают возможность отказаться от переклонирования генов из фаговых в плазмид-ные векторы.
Таким образом, для получения любого белкового продукта необходимо обеспечить правильную транскрипцию кодирующего его гена и трансляцию соответствующей мРНК. Для инициации транскрипции (синтеза РНК) в нужном сайте необходим промотор, для ее остановки -терминирующий кодон.
Для синтеза разнообразных белков, кодируемых клонированными генами, интенсивно используют обычные дрожжи S. сегеvisiае; генетика этих одноклеточных организмов хорошо изучена. Рекомбинантные белки, синтезированные в системах экспрессии S. сегеvisiае, применяют в качестве вакцин и лекарственных препаратов
Придавать новые свойства существующим белкам, создавать уникальные ферменты возможно, производя специфические изменения с помощью плазмид или ПЦР. Клонированные гены позволяют получать белки, содержащие нужные аминокислоты в заданных сайтах. Внесение специфических изменений в кодирующие последовательности ДНК, приводящие к определенным изменениям в аминокислотных последовательностях, называется направленным мутагенезом.
Компетенция. Способность бактериальных клеток воспринимать трансформирующую ДНК (обычно плазмиду).
Механизмы резистентности бактерий к макролидам. Новые полусинтетические макролиды и азалиды - аналоги эритромицина, эффективные в отношении внутриклеточно локализованных возбудителей инфекций.
Антибиотикорезистентность микроорганизмов.
Одновременно с расширением области применения антибиотиков увеличилось число патогенных штаммов микроорганизмов, проявляющих повышенную устойчивость к отдельным или нескольким антибиотикам, что привело к снижению, а в ряде случаев к потере эффективности примененных препаратов.
Появление устойчивых штаммов микроорганизмов обусловлено включением в рацион антибиотиков в качестве кормовых добавок. У поросят, получавших с кормом хлортетрациклин, выделяли кишечные палочки, устойчивые не только к этому препарату, но и к стрептомицину, левомицитину и сульфаниламидам. Признак устойчивости при конъюгации передавали 40% таких штаммов.
Увеличение числа резистентных микроорганизмов вызвало необходимость детального изучения причин появления факторов, способствующих их распространению и последующей разработки методов предупреждения и преодоления лекарственной устойчивости возбудителей инфекционных заболеваний.
Различают природную устойчивость, связанную с особенностями данного вида микроорганизмов, приобретенную устойчивость и трансмиссивную лекарственную устойчивость.
Примером природной устойчивости может служить невосприимчивость к бензилпенициллину эшерихий, которая основана на особенностях структуры их оболочки, затрудняющей доступ антибиотика к чувствительному субстрату.
Приобретенная устойчивость развивается благодаря способности отдельных бактериальных клеток к мутации, которая не является направленной и не связана с воздействием лекарственных веществ. В результате же применения антибиотика, который в этом случае играет роль селективного агента, чувствительные клетки погибают, а устойчивые мутанты выживают, размножаются и становятся источником распространения антибиотикорезистентных штаммов.
С генетической точки зрения приобретенная устойчивость есть приобретение клеткой нового признака, который не отражается на таксономическом положении бактерий, и может быть утрачен без изменения остальных признаков. По скорости возникновения приобретенная устойчивость делится на два типа: стрептомициновый, возникающий путем одноступенчатой мутации, когда устойчивые мутанты популяции выявляются после одно-, двукратного контакта с антибиотиком, и пенициллиновый, возникающий путем многоступенчатых мутаций, когда устойчивые мутанты популяции выявляются после многократного контакта с антибиотиком.
Комитетом экспертов ВОЗ одобрено два определения устойчивости бактерий. В клиническом смысле микроорганизм условно может быть признан устойчивым, если он переносит концентрацию антибиотика, которую не представляется возможным достичь в месте инфекции. Устойчивость в клиническом аспекте обусловлена также токсичностью антибиотика, которая может ограничивать дозу вводимого препарата. С бактериологической точки зрения микроорганизм устойчив, если он переносит более высокие концентрации препарата, чем другие штаммы того же вида. Поэтому «устойчивость» - понятие относительное и может считаться абсолютным только в том случае, если микроб совершенно лишен каких-либо структур, на которые действует антибиотик. Например, L-формы бактерий, не имеющие клеточной стенки, являющейся местом действия пенициллина, абсолютно устойчивы к этому антибиотику.
В зависимости от механизма, лежащего в основе приобретенной устойчивости бактерий к антибиотикам, различают ферментативный и толерантный типы устойчивости. Ферментативная устойчивость – это способность бактерий инактивировать антибиотик с помощью специфических энзимов (бета-лактамаза, амидаза и др.).
Трансмиссивная лекарственная устойчивость возникает в результате переноса от клеток-доноров клетками-реципиентами ДНК-содержащего генетического материала, находящегося в хромосомах или расположенного вне хромосом.
Внехромосомные ДНК-содержащие элементы относятся к классу плазмид (эписом). Плазмиды, ответственные за передачу резистентности, носят название R-факторы. Они содержат детерминанты резистентности к антибиотикам и единицы переноса RTF. Для переноса резистентности необходимо сочетание этих генетических структур. Один R-фактор может содержать детерминанты резистентности одновременно к двум и более антибиотикам. Происхождение R-факторов не зависит от применения антибиотиков. Последние в качестве селективных веществ способствуют лишь отбору штаммов-носителей R-факторов. Широкое распространение R-факторов связано главным образом с наличием природного резервуара бактерий-носителей R-факторов (домашние животные, птицы, рыбы, человек и др.), а также с возможностью межбактериальной передачи R-факторов от непатогенных видов патогенным с помощью трех механизмов: трансформации, трансдукции, конъюгации.
Трансформация – процесс передачи ДНК-содержащих материалов от лизированных клеток клетками-реципиентами – представляет собой крайне редкий путь передачи резистентности.
Трансдукция – процесс передачи генетического материала от клеток-доноров клетками-реципиентами с помощью фага – отмечена у стафилококков и энтерококков.
Конъюгация – половой процесс передачи генетического материала при прямом контакте клеток через плазматические мостики – является преобладающим путем передачи резистентности от микробов-доноров микробам-реципиентам одного или разных видов. Передача резистентности конъюгаций установлена для сальмонелл, эшерихий, шегел и других граммотрицательных микроорганизмов.
Широкое распространение носительства R-факторов среди патогенных и непатогенных микроорганизмов, изолированных от сельскохозяйственных животных, свидетельствует о серьезной угрозе снижения эффективности антибиотиков и необходимости изыскания способов предупреждения и подавления передачи R-факторов.
Значительное число исследований посвящено разработке методов подавления межбактериальной передачи резистентности к антибиотикам. Установлено, что некоторые антибиотики (стрептомицин, неомицин, рифампицин, полимексин), нитрофурановые препараты (фурагин, фуразолин), пиронин, кофеин и другие вещества препятствуют передаче трансмиссивной устойчивости к антибиотикам. Одновременно с этим ведутся исследования, направленные на разработку способов преодоления резистентности микроорганизмов к антибиотикам. Учитывая, что хромосомный и плазмидный тип резистентности микроорганизмов к антибиотикам обусловлен субклеточными молекулярными структурами, состоящими из ДНК, представляется возможным применение ДНК-тропных соединений, обладающих свойством элиминировать R- и RTF-факторы или необратимо нарушать генетические функции бактериальной хромосомы. Такими свойствами обладают хинакрин, акрифлавин, митомицин С и некоторые другие вещества. Принимая во внимание, что у резистентных бактерий снижается способность поглощать антибиотики, предприняты попытки изменить чувствительность бактерий к антибиотикам одновременным применением мембранотропных и поверхностно-активных веществ, способных увеличивать проникновение антибиотиков в микробную клетку. Среди испытанных веществ наиболее перспективными оказались протамин, гистоны, имидазолин, а также антибиотики микробомицин и флавомицин. Целесообразен также поиск веществ, повышающих чувствительность к антибиотикам белоксинтезирующей системы бактерий. В частности, отмечено, что протамин гидрохлорид снижает резистентность бактерий к хлорамфениколу.
Большое внимание исследователи разных стран уделяют изучению возможности подавления выделяемых бактериями ферментов, инактивирующих бета-лактамиды, аминогликозиды, хлорамфеникол. Экспериментальные исследования свидетельствуют о том, что наиболее активно угнетают пенициллиназы или элиминируют пенициллиназные плазмиды аниооные детергенты (сульфанол), 3,6-диаминоакридные (профлавин, акрифлавин) и производные антибиотиков (сульфанид феноксиметилпенициллина, оксациллин, цефалотин, цефалоридин). Обнаружены также вещества, подавляющие процесс инактивации хлорамфеникола: производные трифенилметанового ряда, протамин гидрохлорид, пенициллин.
Несомненно, что проведенные эксперименты послужат основой для разработки приемлемых методов борьбы с антибиотикорезистентностью штаммов микроорганизмов. Практически же проблема повышения эффективности антибиотиков в настоящее время решается несколькими путями, наиболее эффективны из которых следующие:
- поиск новых природных антибиотиков, эффективных против болезней, вызываемых резистентными штаммами микроорганизмов;
- получение новых препаратов с лучшими антимикробными фармакокинетическими параметрами путем направленной химической трансформации молекул природных антибиотиков;
- применение сочетаний двух или нескольких антибиотиков с различными механизмами антимикробного действия или антибиотиков с другими терапевтическими веществами с целью затруднить развитие резистентности у возбудителей заболевания и снизить токсичность отдельных компонентов за счет уменьшения дозы каждого из них.
В настоящее время невозможно избавиться полностью от генов резистентности ,однако бороться с антибиотикорезистентностью можно. Известно ,что первоисточник генов резистентности – почвенные микроорганизмы –продуценты антибиотиков.
Например, в-Лактамы инактивируются в-Лактамазами ,которые расщепляют их в-лактамное кольцо. Основной путь борьбы с В-лактамазами – создание молекул ЛС, которые не захватываются активным центром в- лактамаз .Представителями таких ЛС являются полусинтетические антибиотики (оксациллин,метициллин, карбенициллин, и т.д.), которые не чуствительны к пенициллазам.Механизм создания полусинтетических пеициллинов:
- отщепление бензильног радикала ( остается 6- АПК);
-введение химическим путем других радикалов .
Аналогичная работа возможна с цефалоспоринами при присоединении различных радикалов к 7-аминоцефалоспорановой кислоте.
Другим направлением является использование комбинированных препаратов, содержащих антибиотик вместе с ингибитором в-лактамаз . Примеры:
уназин ( ампициллин+сульбактам);
амоксиклав (амоксициллин+клавуновая кислота);
аугментин ( амоксициллин +клавуновая кислота, но в другом соотношении).
Если резистентность обусловлена наличием генов клетки , которые делают мембраны непроницаемыми для антибиотика ( сужаются поры и ли снижается их количество ), то в этом случае можно использовать в-лактамные антибиотики имипинем, карбопинем, веропинем, образующие по сравнению с пенициллином , меньшие по размерам цвиттер –ионы, легко проникающие через пориноваые каналы. Можно использовать имитационные структуры переносчика, жизненно необходимого для клетки, проходящего через пориновые каналы. Так, например был создан цефалоспорин, имтирующий переносчик железа, который ,попадая в клетку ,угнетал синтетаз пептидогликана, ингибируя транспептидазу. Цефалоспорины третьего поколения (цефатазидим), хотя и не расщепляются в–лактамазами ,но являются индукторами выроботки этих в-лактамаз.
Цефалоспорины четвертого поколения (цефипим,цефпиром0 уже не являются индукторами в –лактамаз.
структурная формула амикацина включает фрагмент Мю-оксимаслянной кислоты,который защищает это высокоэффктивный антибиотик от инактивации со стороны изоферментов.
Система активного выброса антибиотиков обнаруживается в цитоплазматической мемране новые белки .проникающие в к летку Эта система включает всебя «белок-ловушку», «ликерный –белок», «белок – помпу», аналогичная ситуация наблюдается в отношении противоопухолевых антибиотиков,что предопределяет их низкую терапевтическую активность.
Дата добавления: 2018-04-04; просмотров: 1012; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
