Водные ресурсы Земли составляет соленая и пресная вода
Водные ресурсы Земли составляет соленая и пресная вода.
Основной запас воды приходится на моря и океаны (1345 млн. км3), в ледниках сосредоточено 30 млн. куб. км, в реках и озерах – 2 млн. км3, атмосфере – 14 тыс.км3и горных породах – 800 млн.км3.
Физические свойства воды.
Чистая вода бесцветная, прозрачная жидкость, без запаха и вкуса. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как у всех других веществ, а возрастает и максимальной плотностью обладает вода при 4°С, а при дальнейшем нагревании плотность ее уменьшается.
Вода обладает аномально большой теплоемкостью равной 4,18 , песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2О – Н2S – H2Se – H2Te,
Tкипения, °С 100 -60 -41 -2
Молекула воды из-за sp3-гибридизации орбиталей атома кислорода имеет угловую конфигурацию, а атомы водорода, соединенные с сильно-электроотрицательным атомом кислорода, определяют ее способность к установлению четырех водородных связей с соседними молекулами.
Потребление воды в быту и на производстве.
Таким образом, чистой пригодной для питья воды на нашей планете находится не так уж много. С развитием нашей цивилизации увеличивается и потребление воды, прежде всего в промышленности.
|
|
|
Так на производство 1 тонны нефти требуется 18 куб. м воды, 1 тонны стали – до 120 куб. м, 1 тонны алюминия 1 500 куб. м, 1 тонны химического волокна – 2 000 куб. м.
Теоретически можно считать водные ресурсы неисчерпаемыми, если принять, что при их рациональном использовании они непрерывно возобновляются в процессе круговорота.
В настоящее время качество воды ухудшилось. Воде грозит настоящая опасность, и исходит она от человечества.
По данным Всемирной организации здравоохранения, инфекционная заболеваемость населения, связанная с водоснабжением, достигает 500 млн случаев в год. По данным санитарно-эпидемиологической службы, многие проблемы со здоровьем возникают из-за употребления некачественной питьевой воды. Каждый год регистрируются случаи заболевания гепатитом, дизентерией и другими острыми кишечными болезнями, причиной которых служит употребление обыкновенной питьевой воды или купание в загрязненных озерах. Кроме того, наша вода нуждается не только в очистке, но и обогащении, поскольку в ней недостаток фтора и йода, что приводит к кариесу, заболеваниям щитовидной железы. Дефицит йода нередко является причиной развития врожденных аномалий, снижения умственных способностей детей. В водопроводной воде, которая поступает в наши дома, недостаточно и селена. Дефицит селена является фактором риска в возникновении сердечно-сосудистых, злокачественных заболеваний, легких.
|
|
|
Жесткость воды способы её устранения.
Дляпотребителя важна такая характеристика воды, которую называют жесткостью.
Какая вода самая жесткая и самая мягкая? (жесткая – морская, мягкая – дождевая). Пресная вода бывает мягкой и жесткой.
Жесткость воды можно определить с помощью обыкновенного мыла. В жесткой воде мыло не мылится, а волосы при мытье секутся.
В природных водах содержатся соли кальция, например, благодаря растворимости гипса CaSO4×2H2O. В присутствии СО2 растворяются в воде карбонаты кальция и магния
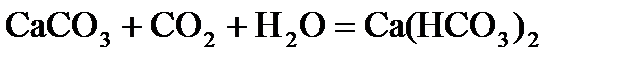
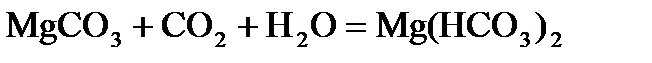
Вода, в которой много растворимых солей Ca и Mg считается жесткой. Жесткость воды выражается числом миллиэквивалентов ионов Са2+ и Mg+2, содержащихся в 1 л Н2О.
Вода считается мягкой, если в литре воды содержание кальция и магния менее 4 мг-экв/л, средней 4-8, жесткой 8-12, очень жесткой – более 12 мг-экв/л.
Жесткость воды, обуславливается наличием в воде гидрокарбонатов кальция и магния (временная), которые в ней диссоциируют на ионы:
|
|
|
Гидрокарбонат кальция = катион кальция + гидрокарбонат анион
При нагревании воды гидрокарбонаты кальция и магния превращаются в нерастворимые карбонаты:
Mg(HCO3)2 = CaCO3↓ + H2O + CO2↑.
Именно они и образуют накипь в чайнике, трубах центрального отопления, паровых котлах.
В жесткой воде мыло плохо пенится, снижается его моющие действия, т.к. соли Ca и Mg образуют с ним нерастворимые соединения. Мыло – Na-соли высокомолекулярных кислот, натрий замещается на Ca2+и образуется осадок.
В жесткой воде плохо развариваются овощи. У животных нарушается Ca-Mg обмен.
Только растворимые соли Ca и Mg обуславливают жесткость воды. Различают временную и постояннуюжесткость воды. Временная (карбонатная) жесткость воды связана с наличием в воде растворимых гидрокарбонатов Ca и Mg. Ее устраняют нагреванием (кипячением).
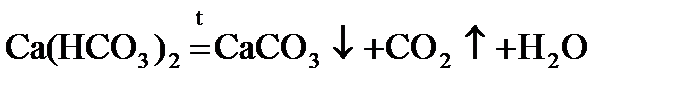
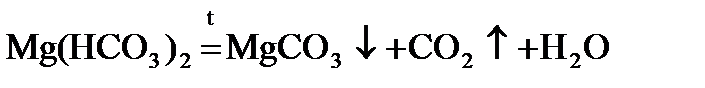
или добавлением известковой воды, фосфатов
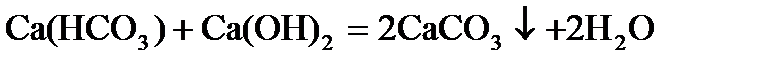 , или
, или
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ + 3Na2CO3 + 3H2O + 3CO2↑
Устранить жесткость – значит получить нерастворимые соли. При этом образуется накипь СаСO3 и MgCO3. Накипь плохо проводит тепло, вызывает увеличение расхода топлива.
Постоянная жесткость обусловлена наличием в растворе Са и Mg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды и извести
|
|
|

MgSO4 + Ca(OH)2 = Mg(OH)2 + Ca SO4¯
Общая жесткость – сумма временной и постоянной жесткости.
Общую жесткость можно удалить действием соды и известкового молока (содово-известковый способ).
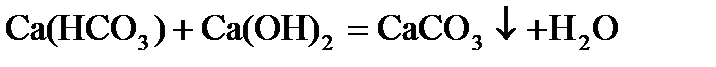
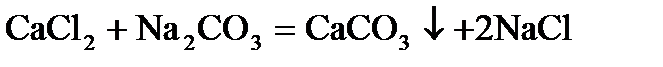 .
.
Все это химические способы устранения жесткости.
Ионы Са2+ и Mg2+ можно удалить из воды посредством катионитов (ионообменных смол), сложных веществ, нерастворимых в воде, способных обменивать свои катионы.
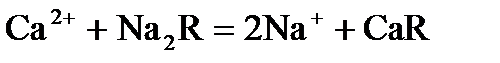 (R – сложный кислотный остаток)
(R – сложный кислотный остаток)
Ионы Са2+ и Mg2+ из воды переходят в катиониты.
Для восстановления катионита, его промывают концентрированным раствором NaCl, катионит потом снова можно использовать для очистки воды.
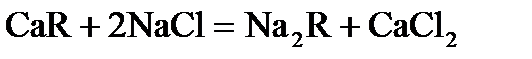
Дата добавления: 2018-02-28; просмотров: 696; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
