Влияние погодных условий на распространение загрязняющих веществ в приземном слое атмосферы
Уровень приземной концентрации вредных веществ в атмосфере от стационарных и подвижных объектов промышленности и транспорта при одном и том же массовом выбросе может существенно меняться в атмосфере в зависимости от техногенных и природно-климатических факторов.
Под техногенными факторами будем понимать интенсивность и объем выброса вредных веществ; высота расположения устья источника выбросов от поверхности земли; размер территории, на которой осуществляются загрязнения; уровень техногенного освоения региона.
К природно-климатическим факторам распространения загрязняющих веществ обычно относят:
· режим циркуляции атмосферы, ее термическую устойчивость;
· атмосферное давление, влажность воздуха, температурный режим;
· температурные инверсии, их повторяемость и продолжительность;
· скорость ветра, повторяемость застоев воздуха и слабых ветров (0¸1 м/с);
· продолжительность туманов;
· рельеф местности, геологическое строение и гидрогеологию района;
· почвенно-растительные условия;
· фоновые значения показателей загрязнения природных компонентов атмосферы;
· состояние животного мира
В природной среде непрерывно меняются температура воздуха, скорость, сила и направление ветра. Поэтому распространение энергетических и ингредиентных загрязнений происходит в постоянно меняющихся условиях. Процессы разложения токсических веществ в высоких широтах при малых значениях солнечной радиации замедляются. Осадки и высокие температуры, наоборот, способствуют интенсивному разложению веществ. Более высокая температура у поверхности земли в дневное время заставляет воздух подниматься вверх, что приводит к дополнительной турбулентности. Ночью температура у поверхности земли более низкая, поэтому турбулентность уменьшается. Это явление приводит к уменьшению рассеивание отработавших газов.
|
|
|
Способность земной поверхности поглощать или излучать теплоту влияет на вертикальное распределение температуры в приземном слое атмосферы и приводит к температурной
инверсии. Повышение температуры воздуха с высотой приводит к тому, что вредные выбросы не могут подниматься выше определенного «потолка». В инверсионных условиях ослабляется турбулентный обмен, ухудшаются условия рассеивания вредных выбросов в приземном слое атмосферы. Для приземной инверсии особое значение имеет повторяемость высот верхней границы, для приподнятой инверсии - повторяемость высот нижней границы.
Сочетание природных факторов, определяющих возможный уровень загрязнения атмосферы, характеризуется метеорологическим и климатическим потенциалом загрязнения атмосферы. Уменьшение концентраций вредных веществ в атмосфере происходит не только вследствие разбавления выбросов воздухом, но и из-за постепенного самоочищения атмосферы.
|
|
|
Нарушение нулевого цикла озона. Причина возникновения озоновых дыр над полюсами.
Реакции образования и разложения озона называют нулевым циклом озона.
Значительный вклад в процесс разрушения озона вносят цепные процессы, протекающие с участием гидроксильных радикалов (водородный цикл), оксидов азота (азотный цикл), соединений хлора и брома (хлорный и бромный циклы).
Озо́новая дыра́ — это локальное падение концентрации озона в озоновом слое Земли.
Поскольку на полюсах наблюдаются долгие полярные ночи, в этих местах происходит резкое снижение температуры и образуются стратосферные облака, содержащие ледяные кристаллики. Как следствие, в воздухе накапливается молекулярный хлор, внутренние связи которого разрываются с наступлением весны и появлением солнечного излучения.
Цепочка химических процессов, возникающих при устремлении в атмосферу атомов хлора, приводит к разрушению озона и образованию озоновых дыр. Когда Солнце начинает светить в полную силу, к полюсам направляются воздушные массы с новой порцией озона, благодаря чему дыра затягивается.
|
|
|
ГИДРОСФЕРА
(16) 1. Гидросфера. Состав. Функции. Особенности физико-химических свойств воды.
Гидросфера — это водная часть биосферы, представленная совокупностью рек, озер, морей и океанов, вод континентов, ледниковых покровов.
Функции:
а) является важнейшим минеральным сырьем, главным природным ресурсом потребления;
б) с участием воды происходят многочисленные процессы в экосистемах (обмен веществ, тепла, рост биомассы);
в) является главным агентом-переносчиком глобальных биоэнергетических экологических циклов;
г) является основной составной частью всех живых организмов.
Особенности физико-химических свойств воды.
1. Удельная Теплоемкость воды выше, чем у всех жидких и твердых веществ (исключение Н2, аммиак)
2. Максимальная плотность воды при 4 градусах. Благодаря тому, что лед легче воды он остается на поверхности.
3. Удельная энтропия воды самая высокая из всех жидких и твердых веществ. Благодаря этому сглаживаются сезонные перепады.
4. При конденсации паров воды в атмосфере происходит выделение получаемой энергии, которая может переходить в кинетическую.
|
|
|
5. Поверхностное натяжение аналогично высокое, значит приводит к появлению ряби и волн на воде, уже при слабом ветре в результате резкого возрастания площади водной поверхности.
(17)2. Понятие редокс-потенциала природных вод. Редокс-буферность.
Окислительная способность природных вод, характеризующая их активность ОВР, называется редокс-реакцией. Большинство наиболее важныхредокс-реакций катализируется микроорганизмами.
Процессы окисления, в природных водах, в большинстве случаев, связано с присутствием в природных водах таких окислителей, как свободные радикалы, пероксид водорода, озон, и др.
Под активностью электронов понимается способность системы поставлять электроны для ОВ процесса. Направление ОВР в природных водах зависит от рН.Активность воды представляется через редокс-потенциал. Он аналогичен значению pH, но характеризует не кол-во ионов водорода, а потенциальную возможность природной воды к участию в ОВР.pe=-lg( 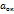 )
)
Энергия Гиббса в ходе ОВР принимает =0. Потенциал, измеряемый по отношению к стандартному водородному электроду, называется стандартным электродным потенциалом Eh. И от того, какое значение (+ или -) имеет данная величина, будет зависеть ОВ активность в растворе.
Величина ОВ потенциала, протекающая с участием ионов водорода, зависит от pH раствора.
Природная вода обычно находится в контакте с О2, в котор. парциал. давлен.молекул кислорода и водорода меньше 1 атмосферы. Поэтому их ОВ потенциалы будут определяться значениями:
pē = 20,78 – pH
pe=-pH.
Под редокс-буферностью понимают способность системы сохранять постоянное значение редокс-уровня за счет присутствия соединений, способных окисляться или восстанавливаться при поступлении в систему небольших количеств окислителей или восстановителей
Восстановление кислорода происходит в две стадии: О2 + 2Н+ + 2ē = Н2О2
Н2 О2+ē = 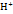 +H2O
+H2O
Если на окисл.проц. израсходован весь кислород, а в систему продолжают поступать орган.в-ва, то ОВР будет идти за счет других соединений.
Денитрификация. Роль реакции состоит в превращении нитрата в биологически инертный молекулярный азот.
В процессе денитрификации помимо азота могут образоваться гемиоксид, оксид и диоксид азота, которые играют важную роль в процессах, протекающих в тропосфере и стратосфере
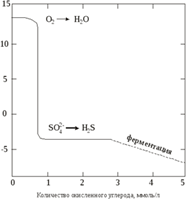
Восстановление сульфатов, или сульфат-редукция. Это реаrции, в которых бактерии используют для окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов жизнедеятельности сульфидные формы.
Если рН воды выше 7, образуется главным образом ион HS–, а в присутствии любых способных к реакциям соединений железа сульфидные формы будут реагировать с ними, образуя осадки в виде сульфидов.
Ферментация. Реакции ферментации представляют собой протекающие при участии микроорганизмов процессы разрушения органических веществ с образованием новых более простых орг. соединений.(образования метана)
(18)3. Особенности процессов окисления в океанах
Особенности ОВ условий в океане связаны с наличием глобальной циркуляции океанических вод. Таким образом, водообмен в океане является непрерывным в отличие от озер. Другое отличие состоит в распределении питательных веществ в океане, а значит, и фотосинтез почти полностью контролируются их регенерацией в водной толще и перераспределением в ходе циркуляции воды, а не поступлением с поверхностным стоком. Отличительной особенностью распределения кислорода в океане является существование зоны, где его содержание минимально. Зона минимального содержания кислорода соответствует глубинному интервалу, где большая часть органического вещества, опускающегося из поверхностной зоны, подвергается разложению. Как правило, воды в зоне минимума остаются аэробными, так как в большей части Мирового океана разлагающегося органического вещества недостаточно для потребления всего кислорода. Зона минимума может стать анаэробной только в районах с исключительно высокой продуктивностью, где восходящие течения возвращают питательные вещества на поверхность. Глубинные воды ниже зоны минимума обычно хорошо аэрированы, поскольку существует постоянный приток кислорода за счет воды, опускающейся у полюсов.
Анаэробные бассейны в океане образуются в тех местах, где имеются препятствия для циркуляции глубинной воды, а продуктивность поверхностного слоя высока. Такие бассейны всегда имеют подводные пороги на уровне зоны минимального содержания кислорода (р.2)

Рис.1 Распределение кислорода с глубиной в океане: А – район средней поверхностной продуктивности; В – район очень высокой поверхностной продуктивности

Рис. 2. Схема образования анаэробного морского бассейна
(19)4. Особенности процессов окисления в озерах
Редокс-условия в озерах определяются балансом между окислением органического вещества и поступлением кислорода за счет циркуляции или вертикального перемешивания воды.
Специфическая зависимость плотности воды от температуры приводит к возникновению ярко выраженной слоистой структуры озер, расположенных в районах с умеренно континентальным климатом
Летом поверхностный слой (эпилимнион) нагревается за счет солнечной радиации. Температура в пределах эпилимниона довольно постоянна, так как поверхностная зона подвержена волновому перемешиванию. Непосредственно под эпилимпиономрасположен метпалимнион, или зона термоклина, – область, в которой температура быстро уменьшается с глубиной. Ниже металимниона находится гиполимниоп – масса одинаково холодной воды. Когда теплая вода малой плотности лежит над холодной водой высокой плотности, смешение и, как следствие, обмен растворенными веществами между эпилимнионом и гиполимнионом затруднены. Такое явление называется термической стратификацией.
Осенью постепенное понижение температуры эпилимниона приведет к тому, что в определенный период, при температуре воздуха около 277 К, вода во всем водоеме будет одинаковой температуры и плотности. При этом в результате волновой деятельности вся вода в водоеме будет перемешана. Такой период называют периодом осеннего водообмена.
В дальнейшем при понижении температуры в верхнем слое воды ее плотность снизится, и в водоеме вновь произойдет разделение на слои различной плотности, обмен между которыми будет затруднен. Это явление называют зимней стратификацией.
Весеннее повышение температуры в зоне эпилимниона приведет к выравниванию температуры и плотности воды во всем водоеме. Начнется процесс весеннего водообмена.
Во время весеннего и осеннего водообмена содержание растворенного кислорода во всем озере в основном соответствует равновесным значениям, характерным для приземного воздуха и воды при температуре 277 К.
В период летней стратификации равновесное количество растворенного в эпилимнионе кислорода снизится по сравнению с периодом водообмена, поскольку растворимость газов уменьшается с ростом температуры.
Следует отметить, что в эпилимнионе в этот период интенсивно протекает фотосинтез, который помимо процесса растворения кислорода из атмосферного воздуха является еще одним источником растворенного кислорода. В некоторых случаях это приводит к нарушению равновесий из-за разности скоростей процессов поступления и выделения, и концентрация растворенного кислорода в некоторых зонах эпилимниона может быть больше равновесной.
В процессе фотосинтеза, как известно, происходит образование органических соединений и кислорода. Помимо углерода для фотосинтеза требуются азот, фосфор и ряд рассеянных элементов. В пресных незагрязненных водах лимитирующим питательным веществом обычно являются фосфаты, в загрязненных водах фотосинтез в некоторых случаях лимитируется нитратами. Лимитирование рассеянными элементами встречается крайне редко.
Когда в озере возникает стратификация, содержание кислорода в воде гииолимниона устойчиво снижается вследствие разложения органического вещества, выпадающего из эпилимниона. Станет ли гиполимнион анаэробным, зависит от суммарного количества органического вещества, поступающего в него в период стратификации, которое контролируется главным образом наличием питательных неорганических веществ, особенно фосфатов в эпилимнионе.
Существует и химическая стратификация. Она встречается там, где вода с более высокой соленостью, образовавшаяся в засушливый период или за счет растворения солей на дне озера, находится под менее соленой поверхностной водой. Такая химическая стратификация может сохраняться многие годы.
(20)5. рН природных вод. Щелочность природных вод.
Для большинства природных вод при pH=7 в соответствии с принципом электронейтральности соблюдается равновесие:
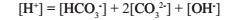
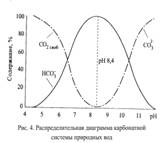
Неорганич. соед-я углерода в прир.водах могут находиться в виде 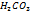 и образуют карбонатную систему
и образуют карбонатную систему
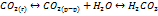
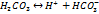
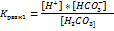
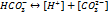
Диссоциация 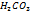 по 2 ступ.протекает крайне медленно
по 2 ступ.протекает крайне медленно
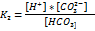
Конст.дис. 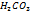 по 2 ступ.приблизительно на 4 порядка меньше 1 ступ. При диссоц.
по 2 ступ.приблизительно на 4 порядка меньше 1 ступ. При диссоц. 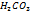 по 1 ступ.концентрации образ-ся
по 1 ступ.концентрации образ-ся 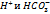 равны между собой.
равны между собой.
Существует зависимость.
Учитыв.малую долю недиссоц. 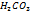 в р-ре и значит.трудн.разделен.отдельн. ионов конц-ю
в р-ре и значит.трудн.разделен.отдельн. ионов конц-ю 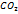 в р-ре оценивают как уравнение:
в р-ре оценивают как уравнение:
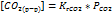
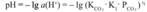
Подобный подход оценки pHпримен., если в воде присутствуют диоксид серы и аммиак.
Щелочность природных вод – способность воды нейтрализовать ионы водорода. Кол-во ионов водорода, идущих на реакцию с карбон.и  , наз-ся карбонатной щелочностью. Участие в реакции всех трех ионов составляет общую щелочность воды:
, наз-ся карбонатной щелочностью. Участие в реакции всех трех ионов составляет общую щелочность воды:
Щ=2  [
[ 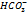 ]+[O
]+[O 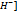 , моль/л
, моль/л
Если pH ниже 4,5, то Щ=0 моль/л. Помимо щелочноси воды сущ-ет понятие основн. р-ра. Это конц-я O 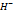 в воде в данный момент времени. Величина щелочности природных вод имеет значение для фотосинтеза.
в воде в данный момент времени. Величина щелочности природных вод имеет значение для фотосинтеза.
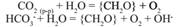
Протекание реакции фотосинтеза в отсутствие достаточного поступления в раствор углекислого газа может сопровождаться значительным увеличением pH. При отсутствии процесса растворения/осаждения щелочность воды остается неизменной.
(21)6. Солёность и жёсткость природных вод. Какие анионы и катионы являются главными ионами природных вод.
Солёность – содержание солей в воде. Качественная питьевая вода содержит не более 0,5г/л солей, такие воды относятся к пресным, менее 0,2г/л – ультрапресные, 0,5-1 – повышенная минерализация, 1-3 – солоноватые воды, 3-10 – солёные, 10-35 – с повышенной солёностью, 35-50 – переходные к рассолам, 50-4000– рассолы.
Жёсткость (Ж) – свойство воды, обусловленное содержанием в ней ионов Са и Mg (моль/м3). Величину общей Жопр-ют по уравнению: Ж=[Ca2+]/20+[Mg2+]/12.
Карбонатная Ж – количество ионов Са и Mg, связанных с карбонат- и гидрокарбонат-ионами. Если данная величина больше общей Ж, то карбонат- и гидрокарбонат-ионы связаны с другими катионами, тогда карбонатная Ж равна общей.
Некарбонатная Ж – это Ж воды, определяемая как разность общей и карбонатной Ж.
Устраняемая Ж – часть карбонатной Ж, устраняемая при кипячении воды. Определяется экспериментально.
Неустраняемая Ж – опр-ся как разность общей и устраняемой Ж.
По величине общей Ж воду делят на группы: менее 1,5моль/м3 – очень мягкая вода; 1,5-3 – мягкая; 3-5,4 –средней жёсткости; 5,4-10,7 – жёсткая; более 10,7 – очень жёсткая.
Сумма катионов в природных водах должна быть равна сумме анионов. Главными ионами морских вод являются:
Na+>Mg2+>Ca2+>K+> …; Cl->SO42->HCO3->Br->…
Главными ионами речной воды являются:
Ca2+>Na+>Mg2+>…; HCO3->SO42->Cl->…
(23)8. Эвтотрофность природных водоёмов.
Эвтрофизация– процесс ухудшения качества воды из-за избыточного поступления в водоём биогенных элементов (соединения азота и фосфора).
К эвтрофным водоёмам относятся неглубокие (до 10–15 м) равнинные озёра с обильным поступлением биогенов. Летом в массовом количестве развивается фитопланктон. Грунты илистые, прозрачность воды низкая, цветность высокая. Водная масса гиполимниона(нижний слой воды в период стратификации) по сравнению с эпилимнионом (верхний слой) мала, бедна кислородом. Водная толща прогревается до дна.
Причины эвтрофизации : почва, богатая минеральными веществами , попадающая в озёра из-за разрушающихся берегов; сельскохозяйственные удобрения; сточные воды животноводческих комплексов; фосфатсодержащие детергенты (ПАВ).
Процесс эвтрофизации, как правило, необратим. Связано это с тем, что фосфаты, однажды попавшие в водоём, не выводятся окончательно в осадок с органическим веществом.
(24)9. Окислительно-восстановительные реакции в гидросфере.
SO4+e -->SO2+O2
Окислительная способность природных вод характеризует их активность. ОВР – редокс реакции.большинство наиболее важных редокс-реакций катализируется микроорганизмами. Инициирование процессов окисления в воде помимо основного окисления кислорода связано также с наличием в воде сульфатов, нитратов, Ме с переменной валентностью, а так же частично с наличием свободных радикалов.
Вост форма + ne ->ок форма
К = Пок/Пвост - en
Под окислительностью элементов принимают способность системы поставлять е для ОВ реакций.
Окислительная способность зависит от ph среды. Для природной воды величина активности может различаться на 20 порядков.
Активность воды представляет через редокс, он аналогичен значению pH, но характеризует не кол-во ионов Н, а потенциальную воз-тьприрродной воды к участию ОВР.
Pe = -lg (аок)
Энергия Гиббса в ходе ОВР = 0
Потенциал, измеряемый по отношению к стандартному Н электроду называется величиной стандартной энергии р-раEhи оттого +/- значение имеет данная величина будет зависеть активность электронов в исследуемом растворе. Величина ОВ потенциала, протекающая с участием ионов Н завист от pH р-ра
Н2О -> O2 +e
H2O +e -> H2+ OH
Природные воды обычно находятся в контакте с воздухом, в котором парциальные давления кислорода и водорода меньше 1 атм, поэтому их ОВ потенциалы будут находиться в интервале значений, определяемых уравнениями
ре- = 20,8 - рН.
ре- = – рН.
(25)10. Редокс – буферность природных вод .
При окислительных процессах с участием О2 в воде, реакция идет в 2 стадии
O2+2H+ +e -> H2O2
H2O2 +e -> H+ + H2O
1. Лимитирующая
Если на окислительные процессы израсходован весь О2, а в систему продолжают поступать органические вещества, то ОВР будут идти за счет других соединений.
1) Денитрификация
Роль данной реакции состоит в превращении нитрата в биологически нейтральный азот.
Сорг + Н++NO3-à N2+CO2+H2O
Кроме молекулярного азота могут образоваться оксид, диоксид, гемеоксид азота.
2) Восстановление сульфатов или сульфат-редуксов – реакция вкоторыхбактерти используют для окисления органических веществ сульфат иона.
Сорг +Н2О +SO42- àH2S + HCO3-
Если pH воды > 7, то обр-я HS
Если в Н2О присутствует активные формы Fe, то будут образовываться его сульфиды.
3) Ферментация – процесс происходит при участии микроорганизмов и приводит к образованию более простых органических соединений.
(Сорг * А)à (Cорг - В) + СО2
Сорг + Н2О = СО2 + СН4
Данная реакция протекает при pH = 4.5
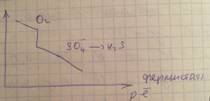
Особенности ОВ процессов в подземных водах:
Основными параметрами природных систем, обусловливающими редокс-уровни природных вод, являются:
Содержание кислорода в инфильтрационных водах. Если инфильтрационные воды поступают в водоносный горизонт по трещинам обнаженных пород (камням), то они обогащены кислородом и характеризуются значительной редокс-буферной емкостью и высокими значениями 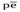 . Когда же фильтрация идет через почвы, богатые органическим веществом, вода может быть анаэробной при поступлении в водоносный горизонт.
. Когда же фильтрация идет через почвы, богатые органическим веществом, вода может быть анаэробной при поступлении в водоносный горизонт.
Распределение и реакционная способность органического вещества и других потенциальных восстановителей в водоносном горизонте. Так, органическое вещество осадочных пород трудно утилизируется бактериями, так как оно является устойчивым.
Распределение веществ, способных создать редокс-буферность водоносного горизонта. В подземных водах массы веществ, способных потенциально создать редокс-буферность, на единицу объема подземной воды довольно велики. Поэтому редокс-уровни подземных вод часто соответствуют величинам 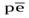 , задаваемым редокс-парами Mn2+/MnO2,Fe2+/Fe(OH)3,Fe2+/Fe2O3.
, задаваемым редокс-парами Mn2+/MnO2,Fe2+/Fe(OH)3,Fe2+/Fe2O3.
Скорость циркуляции подземных вод. Чем больше время пребывания, тем ниже конечное значение 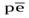 .
.
(26)11. Уникальные свойства воды.
Вода благодаря своему строению (наличию Н связи) имеют ряд аномальных свойств, благодаря которым поддерживается жизнь на земле.
1) Температурная зависимость плотности воды.Максимальная плотность воды наблюдается при t= 4 оС. Благодаря тому, что лед легче воды, он остается на поверхности водоемов, сохраняя в них жизнь круглогодично.
2) Теплоемкость – удельная теплоемкость воды выше, чем у у всех жидких и твердых веществ. (исключение :NH4 и Н2). Она ровна 75.3 Дж/моль*К. Благодаря этому свойству океаны сглаживают колебания t на планете.
3) Удельная энтальпия плавления, является самой высокой среди всех жидких и твердых веществ (исключение :NH3 и Н2). Благодаря данному свойству на земле сглаживаются сезонные переходы.
4) Удельная энтальпия испарения. Ее высокое значение приводит к тому, что большая часть солнечной энергии достигшей поверхности земли расходуется на испарения, препятствуя перегреву поверхности. При конденсации паров воды в атмосфере происходит повышение полученной энергии , которая может переходить в кинетическую.
5) Поверхностное натяжение. Аномально высокое значение приводит к появлению ряби на воде уже при слабом ветре, в результате резко возрастает площадь водной поверхности à интенсифицируются процессы теплообмена между атмосферой и гидросферой. Также с явлением высокого натяжения связаны капиллярные силы воды, благодаря чему вода способна подниматься на высоту до 12 м от уровня грунтовых вод.
6) Диэлектрическая проницаемость. Она определяет самую большую растворяющую способность воды по отношению к веществам с полярной и ионной структурой.
(27)1. Литосфера. Строение. Свойства.
Литосфера – верхняя твердая оболочка Земли, постепенно переходящая в сферы с меньшей прочностью вещества и включающая в себя земную кору и верхнюю мантию Земли. Литосфера – важнейшая часть окружающей природной среды, характеризующаяся площадью, рельефом, почвенным покровом, растительностью, недрами, а также пространством для размещения всех отраслей народного хозяйства. Состояние литосферы меняется во времени под воздействием природных сил и деятельности человека. Она представляет собой «шар» из твёрдого вещества радиусом около 6400км. Земная кора - внешняя оболочка литосферы. Состоит из осадочного, гранитного и базальтового слоев. Отличают океаническую и материковую земную кору. В составе первой отсутствует гранитный слой. Максимальная толщина земной коры около 70 км - под горными системами, 30- 40 км - под равнинами, наиболее тонкая земная кора - под океанами, всего 5- 10 км.
Остальную часть мы называем внутренней литосферой, которая включает также и центральную часть, называемую ядром
Одним из важнейших свойств почвы является её плодородие, т.е. способность обеспечивать органическое и минеральное питание растений. Плодородие зависит от физических и химических свойств почвы.
(28)2. Что такое «Кларк». Охарактеризуйте его расширенное понятие понимание в биогеохимии. Как распределены химические элементы в земной коре.
Средний химический состав земной коры (в %) характеризуется значениями кларковхимических элементов. К настоящему времени установлено, что земная кора бо- лее чем на 99 % состоит всего из 9 элементов: O, Si, Al, Fe, Ca, K, Na, Mg, Ti, на долю остальных элементов, называемых редкими и рассе-янными, приходится всего 0,52 % массы земной коры.
Ввиду неравномерности распределения элементов в земной коре для количественной оценки их распределения используются кларки концентраций: Кк = А/К, где А – содержание элемента в земной коре в данном регионе, % (мас.); К – кларк элемента в земной коре, % (мас.).
Химические элементы входят в состав различных минералов – однородных структур соединений химических элементов, образующихся в земной коре при различных физико-химических процессах. Рассеянные элементы либо изоморфно входят в кристаллические решетки минералов, образованных главными элементами, либо находятся в твердом кристаллическом веществе в неупорядоченном состоянии. Минералы в земной коре, как правило, входят в состав различных горных пород – природных совокупностей минералов более или менее постоянного минералогического состава, образующих самостоятельное тело в земной коре.
(29)3. Фазовый состав, механический состав элементарный состав почв. Условие фазного равновесия.
Почва представляет собой сложную саморегулирующуюся поликомпонентную многофазную систему. Выделяют четыре физические фазы почвы — твердую, жидкую, газовую и живую.
Твердая фаза — скелет почвы, прочная основа, состоящая из минеральной (95—99 %) и органической частей. Минеральная часть сформировалась из материнских геологических пород и содержит остаточные и вторичные.
Жидкая фаза почвы представляет собой почвенный раствор, который формируется из воды, поступающей в почву с атмосферными осадками, из грунтовых вод, при конденсации водяных паров.
Газовая фаза почвы представлена почвенным воздухом, который заполняет свободные от воды пустоты (поры) в почве. Источником почвенного воздуха являются воздух атмосферы и образующиеся в почве газы.
Живая фаза почвы представлена живыми организмами, населяющими почву и участвующими в почвообразовательном процессе. Это в первую очередь различные микроорганизмы а также простейшие, насекомые, черви и др.
В результате процессов выветривания плотные горные породы превращаются в рыхлую массу, состоящую из частиц различного размера, которые называются механическими элементами. Механические элементы, близкие по размерам, объединяются во фракции. Совокупность механических фракций представляет механический состав почвы. Механический состав почвы является важной характеристикой, необходимой для определения производственной ценности почвы, ее плодородия, способов обработки и т. д. От механического состава почвы зависят почти все физические и физико-механические свойства почвы: влагоемкость, водопроницаемость, порозность, воздушный и тепловой режим, водоподъемная сила и др.
Элементный состав – один из важнейших факторов, который обусловливает выбор методов химического и физико-химического анализа почв.
По абсолютному содержанию в почвах все элементы могут быть объединены в несколько групп. В первую группу следует отнести кислород и кремний, содержание которых составляет десятки процентов. Вторая группа включает элементы, содержание которых в почве меняется от десятых долей до нескольких процентов: это Al, Fe, Ca, Mg, K, Na, C. Первые две группы – типичные макроэлементы. В третью группу входят Ti, Mn, N, P, S, H, концентрации которых измеряются десятыми и сотыми долями %. Они составляют переходную группу. Микро- и ультрамикроэлементы содержатся в почвах в количестве 10-3…10-10%; к ним можно отнести все остальные элементы, встречающиеся в почвах: Ba, Sr, Cu, Cr и т. д.
(30)4. Органические вещества почвы, гумус. Химический состав гумуса.
Органическое вещество почвы — это сложная система всех органических веществ, присутствующих в профиле в свободном состоянии или в форме органоминеральных соединений, исключая те, которые входят в состав живых организмов.
Органические остатки представлены главным образом наземным и корневым опадом высших растений, который не утратил своего анатомического строения.
Гумус представляет собой совокупность всех органических соединений, находящихся в почве, кроме входящих в состав живых организмов и органических остатков, сохранивших анатомическое строение.
В составе гумуса выделяют неспецифические органические соединения и специфические — гуминовые вещества.
Неспецифическими называется группа органических веществе известной природы и индивидуального строения. Они поступают в почву из разлагающихся растительных и животных остатков и с корневыми выделениями.
Специфическая органическая часть почвы — гуминовые вещества — представляют собой неоднородную полидисперсную систему высокомолекулярных азотсодержащих ароматических соединений кислотной природы. Гуминовые вещества образуются в результате сложного биофизико-химического процесса трансформации (гумификации) продуктов разложения органических остатков, попадающих в почву.
Важнейшими группами являются гуминовые кислоты (ГК) и фульвокислоты (ФК).
Количественной мерой типа гумуса служит отношение содержания углерода гуминовых кислот (Сгк) к содержанию углерода фульвокислот (Сфк). По величине этого отношения (Сгк/Сфк) можно различить четыре типа гумуса:
— гуматный — более 2;
— фульватно-гуматный — 1—2;
— гуматно-фульватный — 0,5—1,0;
— фульватный — менее 0,5.
Гуминовые вещества почвы обладают высокой реакционной способностью и активно взаимодействуют с минеральной матрицей. Под влиянием органических веществ разрушаются неустойчивые минералы материнской породы и химические элементы становятся доступнее для растений. В процессе органо-минеральных взаимодействий образуются почвенные агрегаты, что улучшает структурное состояние почвы.
Фульвокислоты наиболее активно разрушают почвенные минералы .Фульваты щелочных и щелочноземельных оснований хорошо растворимы в воде и легко мигрируют вниз по профилю. Важная особенность ФК — их неспособность закреплять кальций. Поэтому известкование кислых почв приходится проводить регулярно, через 3—4 года.
Гуминовые кислоты в противоположность ФК образуют с кальцием плохо растворимые органоминеральные соединения (гуматы кальция). Благодаря этому в почвах формируются гумусово-аккумулятивные горизонты. Гуминовые вещества почвы связывают ионы многих потенциально токсичных металлов — Al, Pb, Cd, Ni, Co, что снижает опасное влияние химического загрязнения почв.
(31) 5. Поглотительная способность почв. Почвенно-поглощающий комплекс, обменные катионы. Емкость каталитического обмена.
Почвенный поглощающий комплекс — это совокупность минеральных, органических и органоминеральных компонентов твердой части почвы, обладающих ионообменной способностью.
Катионный обмен — частный случай ионного обмена, под которым в химии понимают обратимый процесс обмена ионами между двумя контактирующими фазами. Материальным носителем катионообменной способности почв является ППК.
Реакцию обмена катионов А и Б формально можно записать так:
П(А )m + nБ ↔ П(Б )n + mА ,где П — ППК.. Эта форма записи показывает, что ППК— отдает в раствор катионы в обмен на эквивалентное количество катионов другого рода.
в ППК входят и способные к обменным реакциям катионы; в противном случае этот комплекс не смог бы выделить в ходе реакции эквивалентное количество катионов в обмен на катионы почвенного раствора. Не все твердые фазы почв способны проявлять катионообменную способность. Способность к поглощению и обмену катионов сосредоточена главным образом в илистой фракции почв.
Катионы, которые входят в состав ППК и могут быть замещены Катионами другого рода при взаимодействии с нейтральными растрами солей, называют обменными катионами, в качестве синонима употребляют термин поглощенные катионы. При характеристике ППК и обменных реакций часто используют термин обменные основания, под которым понимают только обменные катионы Са2+, Мg2+, К+ и Na+, тогда как в число обменных катионов входят кроме того, Н+, А13+ и др.
по определению Бренстеда — Лоури, основаниями называют вещества, способные соединяться с ионами водорода. Основаниями, следовательно, являются не сами катионы Са2+, Nа+ и т. д., а их гидроксиды.
Емкость катионного обмена.
Важнейшей характеристикой почвенного поглощающего комплекса и почвы в целом является емкость катионного обмена (ЕКО). Величина ЕКО существенно зависит от рН взаимодействующего с почвой раствора и несколько варьирует при замене одного вида насыщающего катиона на другой.
Под емкостью катионного обмена будем понимать общее количество катионов одного рода, удерживаемых почвой в обменном состоянии при стандартных условиях и способных к обмену на катионы взаимодействующего с почвой раствора. Величину емкости катионного обмена выражают в миллиграмм-эквивалентах на 100 г почвы или ее фракции.
3 вида ЕКО:
• емкость катионного обмена стандартную определяют с помощью буферных растворов при постоянном значении рН.
• емкость катионного обмена реальную (или эффективную) определяют путем обработки почвы небуферными растворами солей о реальной емкости катионного обмена можно судить с достаточной точностью по сумме обменных катионов;
• дифференциальная (или рН-зависимая) емкость катионного обмена характеризует приращение емкости катионного обмена с увеличением рН равновесного раствора: ∆ЕКО/DрН. Чтобы найти дифференциальную ЕКО, почву насыщают катионами одного рода из буферных растворов с различными значениями рН (например 6,5 и 8,2), а затем рассчитывают общее приращение ЕКО или её приращение на единицу рН.
Величина ЕКО зависит от числа отрицательных зарядов, приходящихся на единицу массы или поверхности ППК. Обменные катионы компенсируют отрицательный заряд, и в отсутствие внешнего электрического поля каждая частица ППК электронейтральна.
17.(1)
Дата добавления: 2018-02-28; просмотров: 1544; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
