Библиографический список
- Голиков Г.А. Руководство по физической химии. М.:Высш. шк., 1988
- Жуховицкий А.А., Шварцман Л.А. Физическая химия. М.: Металлургия,2001. – 688 с.
- Зимон А.Д. Физическая химия: Учебник для вузов. М.: Агар 2003. – 320с.
- Стромберг А.Г., Семченко Д.Т. Физическая химия: Учебник. М.: Высшая школа, 2003. – 527 с.
- Краткий справочник физико-химических величин/ Под ред. А.А.Равделя, А.М.Пономаревой М.: Химия, 2002. – 159 с.
.
ПРИЛОЖЕНИЕ 4
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ
| Вещество | 
| 
| Коэффициенты в уравнении 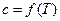 : :  , , 
| ||||||||||||||

| 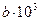
| 
| |||||||||||||||
| Простые вещества | |||||||||||||||||
| Аg(тв) | 42,55 | 23,97 | 5,27 | -0,25 | |||||||||||||
| Al(тв) | 28,33 | 20,67 | 12,38 | — | |||||||||||||
| Br2(г) | 30,91 | 245,37 | 37,32 | 0,50 | -1,26 | ||||||||||||
| C(тв) | 5,74 | 16,86 | 4,77 | -8,54 | |||||||||||||
| Cd(тв) | 51,76 | 22,22 | 12,30 | — | |||||||||||||
| Cl2(г) | 121,3 | 165,09 | 23,14 | -0,67 | -0,96 | ||||||||||||
| CI2(г) | 222,98 | 37,03 | 0,67 | -2,85 | |||||||||||||
| Cr(тв) | 23,64 | 24,43 | 9,87 | -3,68 | |||||||||||||
| Cu(тв) | 33,14 | 22,64 | 6,28 | — | |||||||||||||
| Fe(тв) | 27,15 | 17,24 | 24,77 | — | |||||||||||||
| H2(г) | 130,52 | 27,28 | 3,26 | 0,50 | |||||||||||||
| I2(г) | 62,43 | 260,60 | 37,40 | 0,59 | -0,71 | ||||||||||||
| Mn(тв) | 32,01 | 23,85 | 14,14 | -1,59 | |||||||||||||
| N2(г) | 191,50 | 27,88 | 4,27 | — | |||||||||||||
| Ni(тв) | 29,87 | 16,99 | 29,46 | — | |||||||||||||
| О2(г) | 205,04 | 31,46 | 3,39 | -3,77 | |||||||||||||
| РЬ(тв) | 64,81 | 24,23 | 8,71 | — | |||||||||||||
| S2(г) | 128,37 | 228,03 | 36,11 | 1,09 | -3,51 | ||||||||||||
| Ti(тв) | 30,63 | 21,10 | 10,54 | — | |||||||||||||
| Zn(тв) | 41,63 | 22,38 | 10,04 | — | |||||||||||||
| Неорганические соединения | |||||||||||||||||
| AgCl(тв) | -126,78 | 96,23 | 62,26 | 4,18 | -11,30 | ||||||||||||
| АgI(тв) | -61,92 | 115,48 | 24,35 | 100,83 | — | ||||||||||||
| Аg2O(тв) | -30,54 | 121,75 | 55,48 | 29,46 | — | ||||||||||||
| Ag2S(тв) | -31,80 | 143,51 | 64,60 | 39,96 | — | ||||||||||||
| AlBr3(тв) | -526,20 | 184,00 | 78,41 | 78,08 | — | ||||||||||||
| AlCl3(тв) | -697,40 | 167,00 | 55,44 | 117,15 | — | ||||||||||||
| Аl2О2(тв) | -1675,69 | 50,92 | 114,55 | 12,89 | -34,31 | ||||||||||||
| СO(г) | -110,53 | 197,55 | 28,41 | 4,10 | -0,46 | ||||||||||||
| СO2(г) | -393,51 | 213,66 | 44,14 | 9,04 | -8,54 | ||||||||||||
| COCl2(r) | -219,50 | 283,64 | 67,15 | 12,03 | -9,04 | ||||||||||||
| COS(r) | -141,70 | 231,53 | 48,12 | 8,45 | -8,20 | ||||||||||||
| CaCl2(тв) | -795,92 | 108,37 | 71,88 | 12,72 | -2,51 | ||||||||||||
| СаО(тв) | -635,09 | 38,07 | 49,62 | 4,52 | -6,95 | ||||||||||||
| CdBr2(тв) | -314,80 | 83,4 | — | — | |||||||||||||
| CdCl2(тв) | -390,79 | 115,27 | 61,25 | 40,17 | — | ||||||||||||
| CdO(тв) | -256,10 | 54,80 | 40,38 | 8,70 | — | ||||||||||||
| СrСl3(тв) | -554,80 | 122,90 | 81,34 | 29,41 | — | ||||||||||||
| Сr2О3(тв) | -1140,56 | 81,17 | 119,37 | 9,20 | -15,65 | ||||||||||||
| CS2(r) | 115,30 | 237,8 | 52,09 | 6,69 | -7,53 | ||||||||||||
| CuCl2(тв) | -205,85 | 108,07 | 67,44 | 17,56 | — | ||||||||||||
| FеО(тв) | -264,85 | 60,75 | 50,80 | 8,61 | -3,31 | ||||||||||||
| Fe2O3(тв) | -822,16 | 87,45 | 97,74 | 72,13 | -12,89 | ||||||||||||
| Fe3O4(TB) | -1117,13 | 146,19 | 86,27 | 208,92 | — | ||||||||||||
| HBr(r) | -36,38 | 198,58 | 26,15 | 5,86 | 1,09 | ||||||||||||
| HCI(r) | -92,31 | 186,79 | 26,53 | 4,60 | 1,09 | ||||||||||||
| HF(r) | -268,61 | 173,51 | 27,70 | 2,93 | — | ||||||||||||
| hi(г) | 26,36 | 206,48 | 26,32 | 5,94 | 0,92 | ||||||||||||
| H2O(г) | -241,81 | 188,72 | 30,00 | 10,71 | 0,33 | ||||||||||||
| H2S(г) | -20,60 | 205,70 | 29,37 | 15,40 | — | ||||||||||||
| MnO(тв) | -385,10 | 61,50 | 46,48 | 8,12 | -3,68 | ||||||||||||
| MnO2(тв) | -521,49 | 53,14 | 69,45 | 10,21 | -16,23 | ||||||||||||
| Мn2О3(тв) | -957,72 | 110,46 | 103,50 | 35,06 | -13,51 | ||||||||||||
| Мn3О4(тв) | -1386,58 | 148,53 | 144,90 | 45,27 | -9,20 | ||||||||||||
| NH3(г) | -46,19 | 192,50 | 29,80 | 25,48 | -1,67 | ||||||||||||
| NO(r) | 91,26 | 210,64 | 29,58 | 3,85 | -0,59 | ||||||||||||
| NO2(r) | 34,19 | 240,06 | 41,16 | 11,33 | -7,02 | ||||||||||||
| N2O(r) | 82,01 | 219,83 | 45,69 | 8,62 | -8,53 | ||||||||||||
| N2O4(г) | 9,37 | 304,30 | 83,89 | 39,75 | -14,90' | ||||||||||||
| NiO(тв) | -239,74 | 37,99 | -20,88 | 157,23 | 16,28 | ||||||||||||
| NiS(тв) | -79,50 | 52,97 | 38,70 | 26,78 | — | ||||||||||||
| PCl3(г) | -287,02 | 311,71 | 80,11 | 3,10 | -7,99 | ||||||||||||
| PCl5(r) | -374,89 | 364,47 | 129,49 | 2,92 | -16,40 | ||||||||||||
| PbBr2(тв) | -282,42 | 161,75 | 77,78 | 9,20 | — | ||||||||||||
| PbI2(тв) | -175,23 | 175,35 | 75,31 | 19,66 | — | ||||||||||||
| PbO(тв) | -217,61 | 68,70 | 37,87 | 26,78 | — | ||||||||||||
| SiF4(r) | -1548,00 | 281,60 | 91,46 | 13,26 | -19,66 | ||||||||||||
| SiO2(тв) | -859,30 | 42,09 | 46,94 | 34,31 | -11,30 | ||||||||||||
| SO2(r) | -296,90 | 248,07 | 46,19 | 7,87 | -7,70 | ||||||||||||
| SO2Cl2(г) | -363,17 | 311,29 | 87,91 | 16,15 | -14,23 | ||||||||||||
| SO3(г) | -395,85 | 256,69 | 64,98 | 11,75 | -16,37 | ||||||||||||
| TiO2(тв) | -944,1 | 50,28 | 75,24 | 1,17 | -18,21 | ||||||||||||
| ZnO(тв) | -348,11 | 43,51 | 48,99 | 5,10 | -9,12 | ||||||||||||
| ZnS(тв) | -205,18 | 57,66 | 49,25 | 5,27 | -4,85 | ||||||||||||
ПРИЛОЖЕНИЕ 5
|
|
|
|
|
|
Вопросы для самоподготовки
1. Выделяется или поглощается теплота в реакции в изученном интервале температур?
2. Как меняется тепловой эффект реакции с ростом температуры и почему?
3. Как изменяется энтропия реакции с ростом температуры и почему?
4. Согласуются ли зависимости на рис. 2 и 3? Поясните.
5. По знаку изменения энергии Гиббса определите возможное направление реакции при стандартных условиях.
6. Возможно ли равновесие в системе при стандартных условиях? Если нет, то при какой температуре это возможно?
7. Выразите константу равновесия реакции через активности, парциальные давления и объёмные проценты газообразных веществ, считая их идеальными, а конденсированные вещества – чистыми.
|
|
|
8. Объясните влияние температуры на характер изменения константы равновесия. Согласуются ли рис. 1 и 4 между собой?
9. Как влияет температура и давление на равновесие реакции?
10. Определите вариантность системы в состоянии равновесия. Ответ поясните.
Дата добавления: 2015-12-21; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
