Другие случаи расчета равновесного состава газовой смеси
 Среди реакций предложенных в настоящем задании лишь немногие имеют константы равновесия, близкие к единице ( обратимыереакции). Чаще встречаются случаи необратимых реакций, когда величина константы равновесия либо очень велика (Кр>>103), либо очень мала ( Кр<<103 ). Кроме того, газовая фаза может содержать более двух компонентов. Рассмотрим произвольную реакцию:
Среди реакций предложенных в настоящем задании лишь немногие имеют константы равновесия, близкие к единице ( обратимыереакции). Чаще встречаются случаи необратимых реакций, когда величина константы равновесия либо очень велика (Кр>>103), либо очень мала ( Кр<<103 ). Кроме того, газовая фаза может содержать более двух компонентов. Рассмотрим произвольную реакцию:

с исходной концентрацией реагентов 

 , что соответствует их мольным долям:
, что соответствует их мольным долям: 

 при общем давлении:
при общем давлении:  .
.
а. Константа равновесия очень велика
Для реакции (I) константа равновесия опишется уравнением


Т.к. константа равновесия очень велика, например Кp = 1034, то очевидно, что реакция, при данных фактическихконцентрациях реагентов, протекает необратимо вправо. При этом концентрация продуктов реакции будет увеличиваться, a исходных веществ - уменьшаться. Если число молей вещества R увеличится на "х", то число вещества Qувеличитсяна "5x", а число молей реагента B уменьшится на "2х".
Таким образом, при равновесии количество молей реагентов будут определяться величинами: 


Мольные доли компонентов составят:



Равновесные парциальные давления:


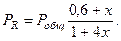
Подставив эти значения в уравнение (2) получим:


Левая часть уравнения представляет собой отношение двух конечных чисел, а правое очень большое число (1034). Такая ситуация возможна только в случае, если знаменатель стремится к нулю, т.е. либо  или
или  Приравнивая последние уравнение к нулю и решая их. Получим два корня:
Приравнивая последние уравнение к нулю и решая их. Получим два корня:  и
и 
|
|
|
Физический смысл имеет положительный корень, тогда равновесные мольные доли реагентов составят:



Таким образом, равновесная газовая фаза будет состоять только из двух реагентов: Q и R, причем их содержание в ней будет:


b. Константа равновесия очень мала
Поскольку константа равновесия очень мала, например Кp = 10 – 34, то очевидно, что реакции, при данных фактических концентрациях реагентов, протекает необратимо влево. При этом концентрация продуктов реакции будет уменьшаться, а исходных веществ - увеличиваться, Если число молей вещества R уменьшится на "х", то число вещества Q уменьшится на "5х", а число молей реагента B увеличится на "2х".
Таким образом, при равновесии количество молей реагентов будут определяться величинами: 


При этом их мольные доли составят:



Равновесные парциальные давления определяются:



Подставив эти значения в уравнение (2) получим:


Левая часть уравнения представляет собой отношение двух конечных чисел, а правая очень малое число (10 – 34). Такая ситуация возможна только в случае, если числитель стремится к нулю, т.е. либо  или
или  Приравнивая последние уравнения к нулю и решая их. Получим два корня:
Приравнивая последние уравнения к нулю и решая их. Получим два корня:  и
и  . Физический смысл имеет первый корень, т.к. в случае допущения правильности второго корня получится отрицательное количество компонента Q. Равновесные мольные доли реагентов составят:
. Физический смысл имеет первый корень, т.к. в случае допущения правильности второго корня получится отрицательное количество компонента Q. Равновесные мольные доли реагентов составят:
|
|
|



Таким образом, равновесная газовая фаза будет состоять только из двух реагентов: В и R, причем их содержание в ней будет:

Дата добавления: 2015-12-21; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
