Формулировка задания
ВВЕДЕНИЕ
Расчеты химических равновесий являются важнейшим этапом рассмотрения любых металлургических процессов. Предлагаемое руководство позволяет на основе термодинамических характеристик простых веществ и соединений рассчитать изменения термодинамических функций 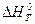 ,
,  ,
,  и далее
и далее  для различных химических превращений и определить состав равновесной системы при различных условиях протекания процесса. Необходимость подобных расчетов возникает на всем протяжении учебного процесса: в курсах физической химии, теории металлургических процессов, специальных курсах, а также в курсовых научно-исследовательских работах, курсовых и дипломных проектах.
для различных химических превращений и определить состав равновесной системы при различных условиях протекания процесса. Необходимость подобных расчетов возникает на всем протяжении учебного процесса: в курсах физической химии, теории металлургических процессов, специальных курсах, а также в курсовых научно-исследовательских работах, курсовых и дипломных проектах.
Цель задания - освоение методики расчета термодинамических характеристик химической реакции с помощью таблиц стандартных термодинамических величин. При выполнении задания студент определяет по справочным таблицам необходимые характеристики компонентов реакции и находит далее стандартные изменения энтальпии 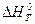 , энтропии
, энтропии  , энергии Гиббса
, энергии Гиббса  , а затем константы равновесия
, а затем константы равновесия  . Располагая этими величинами, можно определить направление реакции, ее тепловой эффект при заданной температуре, оценить выход продуктов реакции, рассчитать состав равновесной системы и изменение всех этих характеристик при изменении внешних параметров, подобрать оптимальные условия проведения процесса.
. Располагая этими величинами, можно определить направление реакции, ее тепловой эффект при заданной температуре, оценить выход продуктов реакции, рассчитать состав равновесной системы и изменение всех этих характеристик при изменении внешних параметров, подобрать оптимальные условия проведения процесса.
ФОРМУЛИРОВКА ЗАДАНИЯ
|
|
|
Для реакции аА + bВ = cC + dD (вариант и номер задания указаны в колонках 1 и 2 табл.1), где А, В, С, D - вещества - участники реакции (колонки 3, 4, 5, 6 в табл.1); a,b,c,d - стехиометрические коэффициенты реакции выполнить следующее:
1. Составить уравнение зависимости от температуры величины теплового эффекта  и изменения энтропии
и изменения энтропии 
2. Вычислить величины 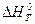 ,
,  ,
,  и
и  при нескольких температурах, значения которых задаются температурным интервалом и шагом температур (колонки 7 и 9 в табл.1). Полученные значения свести в таблицу и построить графики в координатах:
при нескольких температурах, значения которых задаются температурным интервалом и шагом температур (колонки 7 и 9 в табл.1). Полученные значения свести в таблицу и построить графики в координатах:
 ;
; 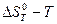 ;
;  ;
; 
3. Пользуясь графиком  , вывести приближенное уравнение вида
, вывести приближенное уравнение вида 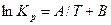 , где А, В - постоянные.
, где А, В - постоянные.
4. Используя правило фаз Гиббса, для рассматриваемой системы определить количество фаз, независимых компонентов и число степеней свободы.
5. Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при заданном давлении и температуре (колонки 14 и 15 в табл.1). При решении из задачи использовать выведенное в первой части эмпирическое уравнение 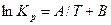 и данные об исходном составе газовой фазы (колонки 10, 11, 12, 13 в табл.1).
и данные об исходном составе газовой фазы (колонки 10, 11, 12, 13 в табл.1).
6. Установить направление смещения состояния равновесия рассматриваемой системы при:
|
|
|
а) увеличении температуры (при постоянном давлении);
б) увеличении давления (при постоянной температуре).
Дата добавления: 2015-12-21; просмотров: 25; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
