Биосинтез зубного налета
Биосинтез декстранов осуществляется путем расщепления сахарозы с послед. переносом остатка глюкозы на акцептор, к-рым м. б. сахароза или растущая цепь декстрана. Р-ция катализируется ферментом декстрансахаразой.

При участии ферментов бактерий зубного налета, из глюкозы синтезируются полимеры — декстран, из фруктозы — леван. Последоват. присоединение остатков -D-фруктофуранозы, к фруктозному остатку 6-кестозы дает леван (в бактериях).
Биосинтез муреина. Его первой стадией является синтез характеристичного моносахарида. Вначале в цитоплазме из Тчацетилглюкозамин-1-фосфата и УТФ образуется уридин-N-ацетилглюкозамин. Затем в положение 3 этого нуклеотида (в две стадии) присоединяется остаток молочной кислоты и образуется уридиндифосфо-Ы-ацетилмураминовая кислота [ацетилмураминовая кислота — сахар, встречающийся только в клеточной стенке прокариот]. К ней присоединяются пять аминокислотных остатков, причем концевой всегда является napa-D-аланил-О-аланин.

13.НАД(Ф) -зависимые дегидрогеназы, катализирующие протоны водорода от молекул различных субстратов и передающие его на стартовый переносчик дыхательной цепи - НАД(Ф)*Н2-дегидрогеназу, - растворимые ферменты. Дегидрогеназы флавопротеиновой природы, выполняющие аналогичную функцию, могут быть локализованными в мембране (например, сукцинатдегидрогеназа) или существовать в растворимой форме (ацетил-КоA-дегидрогеназы жирных кислот). Водород с них поступает в дыхательную цепь на уровне хинонов.
|
|
|
Известно более 250 НАД(Ф)-зависимых дегидрогеназ, активно участвующих в реакциях промежуточного обмена. Но не все из них имеют отношение к энергетическому метаболизму. С помощью дегидрогеназ осуществляется перенос гидрид-иона (2е + Н+ переходит в Н-) от субстрата к НАД(Ф), при этом в среду переходит протон (рис. 93, А).
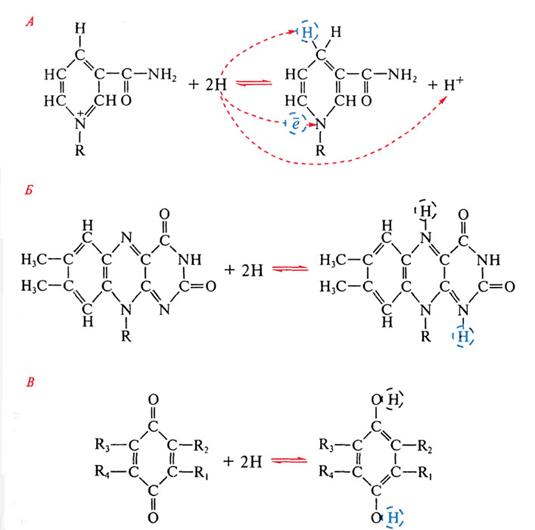
Атом водорода входит в состав пиридинового кольца, а электрон присоединяется к азоту пиридинового кольца. После восстановления НАД(Ф)*Н2 отщепляется от активного центра фермента и переносится к мембране, где акцептируется флавиновой дегидрогеназой и передает ей восстановительные эквиваленты. Одновременно к дегидрогеназе, освобожденной от кофермента, присоединяется окисленная молекула НАД(Ф), поступающая из среды. Таким образом, особенность НАД(Ф) - их подвижность, позволяющая им курсировать от молекул-доноров электронов, находящихся в цитоплазме, к акцепторам электронов, локализованным в мембране.
В состав флавиновых дегидрогеназ входят флавиновые нуклеотиды, прочно связанные с апоферментом и не отщепляющиеся от него ни на одной стадии каталитического цикла. Окислительно-восстановительные свойства флавопротеинов обусловлены способностью изоаллоксазинового кольца рибофлавина к обратимому переходу из окисленного состояния в восстановленное, при котором происходит присоединение к кольцу 2 электронов в составе атомов водорода (рис. 93, Б).
|
|
|
При изучении дыхательных цепей особенно интересны два связанных с мембраной флавопротеина: сукцинатдегидрогеназа, катализирующая окисление сукцината в ЦТК, и НАД(Ф)*Н2-дегидрогеназа, катализирующая восстановление своей флавиновой простетической группы, сопряженное с окислением НАД(Ф)*Н2.
Участие в дыхательном электронном транспорте принимают белки, содержащие железосероцентры (рис. 58).
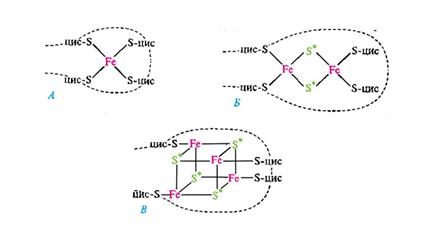
Железосероцентры FeS-белков.
Железосероцентр рубредоксина (А); предполагаемые модели железосероцентров Fe2S2-THna (Б) и Fe4S4-типа (В).
Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис - цистеин.
Они входят в состав некоторых флавопротеинов, например сукцинат и НАД(Ф)*Н2-дегидрогеназ, или же служат в качестве единственных простетических групп белков. Дыхательные цепи содержат большое число FeS-центров. В митохондриальной электронтранспортной цепи функционирует, вероятно, около дюжины таких белков. В зависимости от строения FeS-центры могут осуществлять одновременный перенос 1 или 2 электронов, что связано с изменением валентности атомов железа.
|
|
|
Хиноны - жирорастворимые соединения, имеющие длинный терпеноидный "хвост", связанный с хиноидным ядром, способным к обратимому окислению - восстановлению путем присоединения 2 атомов водорода (рис. 93, В). Наиболее распространен убихинон, функционирующий в дыхательной цепи на участке между флавопротеинами и цитохромами. В отличие от остальных электронных переносчиков хиноны не связаны со специфическими белками. Небольшой фонд убихинона растворен в липидной фазе мембран.
Цитохромы, принимающие участие на заключительном этапе цепи переноса электронов, представляют собой группу белков, содержащих железопорфириновые простетические группы (гемы). С помощью цитохромов осуществляется перенос электронов, в процессе которого меняется валентность железа:
Fe++ переходит обратимо в Fe+++ + e
В митохондриях обнаружено пять цитохромов (b, с, с1, а, а3), различающихся между собой спектрами поглощения и окислительно- восстановительными потенциалами. Различия по этим параметрам обусловлены белковыми компонентами цитохромов, природой боковых цепей их порфиринов и способом присоединения гема к белкам. Конечные цитохромы (а+а3) передают электроны на молекулярный кислород, представляя собой собственно цитохромоксидазу, в реакционном центре которой содержатся помимо двух гемов два атома меди. Образование воды имеет место при переносе на молекулу кислорода 4 электронов. Некоторые цитохромоксидазы осуществляют перенос на О2 только 2 электронов, следствием чего является возникновение перекиси водорода. Перекись водорода далее разрушается каталазой или пероксидазой.
|
|
|
Таким образом, дыхательная цепь переноса электронов в митохондриях состоит из большого числа промежуточных переносчиков, осуществляющих электронный транспорт с органических субстратов на О2. Последовательность их расположения, представленная на рис. 94, подтверждается различного рода данными: значениями окислительно- восстановительных потенциалов переносчиков, ингибиторным анализом.

Схема переноса электронов в дыхательной цепи митохондрий:
ФМН - простетическая группа НАД(Ф)*Н2-дегидрогеназы; ФАД - простетическая группа сукцинатдегидрогеназы; УХ - убихинон; b, с, c1, a, a1 - цитохромы.
Сплошными линиями обозначены процессы, протекающие в мембране; прерывистыми - в цитозоле клетки; зигзагообразной линией показаны места действия ингибиторов.
Обнаружены ингибиторы, специфически действующие на определенные участки дыхательной цепи. Амитал и ротенон блокируют перенос электронов на участке до цитохрома b, действуя предположительно на НАД(Ф)*Н2- дегидрогеназу. Антимицин A (антибиотик, продуцируемый Streptomyces) подавляет перенос электронов от цитохрома b к цитохрому с1. Цианид, окись углерода и азид блокируют конечный этап переноса электронов от цитохромов а+а3 на молекулярный кислород, ингибируя цитохромоксидазу. Если блокировать перенос электронов в электронтранспортной цепи определенными ингибиторами, то переносчики, находящиеся на участке от субстрата до места действия ингибитора, будут в восстановленной, а переносчики за местом действия ингибитора - в окисленной форме.
АН2 + НАД(Ф)+ = А + НАД(Ф)Н + Н+, где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н+. Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.

1.6.Окислительное фосфорилирование АДФ. Механизм сопряжения окисления и фосфорилирования. Коэффициент окислительного фосфорилирования (Р/О).
Витамин РР. Источники. Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Витамин РР может образовываться из триптофана (из 60 молекул триптофана может образоваться 1 молекула никотинамида), что снижает потребность в витамине РР при увеличении количества триптофана в пище.
Суточная потребность в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг.

Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ. Синтез NAD в организме протекает в 2 этапа:

NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы.
NAD+ + АТФ → NADP+ + АДФ
Недостаточность витамина РР приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
14.Липиды транспортируются в водной фазе крови в составе особых частиц –
липопротеинов. Поверхность частиц гидрофильна и сформирована белками, фосфо-липидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро.Белки в липопротеинах обычно называются
апобелками, выделяют несколько их типов –
А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную, ферментативную и кофакторную функции.
Липопротеины различаются по соотношению триацилглицеролов, холестерола и его
эфиров, фосфолипидов и как класс сложных белков состоят из четырех классов.
• хиломикроны (ХМ);
• липопротеины очень низкой плотности
(ЛПОНП, пре-β-липопротеины, пре-β-ЛП);
• липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП);
• липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП).

Дата добавления: 2015-12-20; просмотров: 33; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
