Экспериментальные и расчетные данные
| № опыта | Температура опыта Т, К | Объем Na2S2О3 хi , см3 | Общий объем Na2S2О3 V, см3 | Время появления окрашивания от начала опыта, τ i | Константа скорости реакции k, мин-1 | Энергия активации Е А , кДж/моль | П, % | |||
| мин и с | мин | ki | 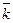
| Е А эксп | Е А теор | |||||
| T 1 T 2 | x 1 = 1 x 2 = 2 x 3 = 3 …. x 1 = 1 x 2 = 2 x 3 = 3 …. | 55,0 |
Обработка экспериментальных данных
1. Отдельно для каждого промежутка времени τ1, τ2, τ3 и т.д. с точностью до четвертого десятичного знака вычисляем константы скорости реакции по формуле

 , мин-1,
, мин-1,
где τ i – время от начала опыта, мин; xi – объем раствора Na2S2О3, соответствующий τ i, см3; V – общий объем раствора Na2S2О3, пошедший на титрование, см3.
2. Рассчитываем среднее значение константы скорости данной реакции при заданной температуре опыта:
 ,
,
где m – количество измерений времени появления синего окрашивания системы.
3. По аналогии рассчитываем значение  при другой температуре.
при другой температуре.
4. Вычисляем энергию активации по формуле (11):
 .
.
5. Определяем относительную погрешность проведения опыта, считая, что теоретическое значение энергии активации данной реакции  .
.
6. Расчетные данные заносим в таблицу формы 5.
7. Оформляем метрологическую карту средств измерения и формулируем выводы.
Дата добавления: 2015-12-18; просмотров: 23; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
